
【题目】下列离子方程式书写正确的是
A. 铜跟硝酸银溶液反应:Cu+Ag+===Cu2++Ag
B. 碳酸钙与盐酸反应:![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C. 硫酸与氢氧化钡溶液反应:H++![]() +Ba2++OH===BaSO4↓+H2O
+Ba2++OH===BaSO4↓+H2O
D. Ba(OH)2与CuSO4溶液反应:Cu2++![]() +Ba2++2OH===BaSO4↓+Cu(OH)2↓
+Ba2++2OH===BaSO4↓+Cu(OH)2↓
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g); ΔH = -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6KJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0KJ·moL-1
(1)氢气燃烧热ΔH=__________;
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式______________。
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为________;反应达到平衡后,升高温度,此时平衡常数将____(填“变大”、“不变”或“变小”)。
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。写出石墨I电极上发生反应的电极反应式_______________________________。在电解池中生成N2O5的电极反应式为__________________________________。

(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物的一氯代物的数目大小排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3 ②(CH3)3CCH(CH3)CH2CH3
③(CH3)3CCH2CH3 ④(CH3)3CCH2C(CH3)3
A. ①>②>③>④ B. ③>②>④>①
C. ③=①>②>④ D. ②>③=①>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯可以进行如下转化:
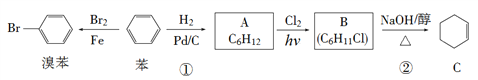
回答下列问题:
(1)反应①的反应类型为________,化合物A的化学名称为___________。
(2)化合物B的结构简式为_________,反应②的反应类型为_______。
(3)如何仅用水鉴别苯和溴苯__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A. a g C2H4和C3H6的混合物所含原子总数为![]()
B. 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
C. 标准状况下,22.4 L H2O含有的分子数为 NA
D. 物质的量浓度为0.5 mol·L1的MgCl2溶液中,含有Cl个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究浓硫酸与蔗糖的炭化产物,设计下图装置进行实验(a和b分別为两个气球)。

已知:CO气体通入氯化钯溶液,溶液变为黑色。
实验过程如下:
I .按图示连接好仪器,然后检验装置的气密性。
II.在双通玻璃管中①②③④处分别放罝滴有酸性高锰酸钾溶液的滤纸、滴有品红溶液的滤纸、浸有氯化钯溶液的滤纸和浸有溴水的滤纸。
III.夹好止水夹K,向三颈烧瓶A中的蔗糖上滴3~4滴蒸馏水,再加入3 mL浓硫酸,玻璃管中③处滤纸由白色变为黑色。
IV.打开止水夹K,使烧瓶内气体缓慢通过B和C装置,一段时间之后,发现④处的滤纸颜色没有发生变化,C中的澄清石灰水变浑浊。
(1)装置A中盛装浓硫酸的仪器名称为______;上述实验体现了硫酸的那些性质_____。
(2)实验步骤III中,向蔗糖上滴水的目的是_________________;
(3)若反应生成两种碳的氧化物相同条件下的体积相同,写出蔗糖炭化后发生反应的化学反应方程式_________。
(4)步骤IV的实验目的是_______________________。
(5)该实验体现了“微型实验”绿色环保的优点,有人建议将装置B改为滴有酸性高锰酸钾溶液的滤纸置于后面的双通玻璃管中,你对该改进建议的评价是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
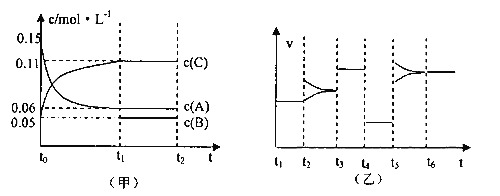
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率v(C)为=_________________。
(2)若t2—t3阶段,C的体积分数变小,此阶段v(正)_____________v(逆)(填“>”“<”“=”)
(3)t4—t5阶段改变的条件为_________________,B的起始物质量为_________________。
(4)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学反应的是( )
A. 对空气进行降温加压 B. 金刚石变成石墨
C. NaCl熔化 D. 碘溶于CCl4中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下: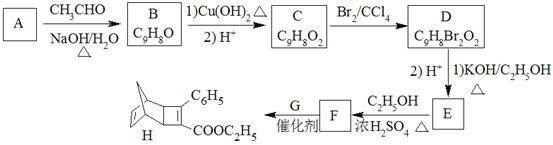
已知:
![]()
![]()
回答下列问题:
(1)A的化学名称为为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶2∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物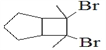 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com