
(12分) 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:

①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ; ______ ____。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
(1)①2NaOH + Cl2=NaCl + NaClO + H2O
②3ClO-+ 10OH-+ 2Fe3+=2FeO42-+ 3Cl-+ 5H2O
③增大K+ 浓度,促进K2FeO4晶体析出
(2)高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,可将杂质一起凝聚而沉降 (3)3∶1
【解析】(1)①氯气溶解在氢氧化钠溶液中,生成氯化钠和次氯酸钠,反应式为2NaOH + Cl2=NaCl + NaClO + H2O。
②次氯酸钠具有氧化性,能把硝酸铁氧化生成高铁酸盐,而次氯酸钠被还原生成氯化钠,反应式为3ClO-+ 10OH-+ 2Fe3+=2FeO42-+ 3Cl-+ 5H2O。
③加入饱和氢氧化钾溶液,能增大钾离子浓度,促使K2FeO4晶体析出。
(2)高铁酸钾具有强氧化性,能杀菌消毒,还原产物是铁离子。而铁离子能水解生成氢氧化铁胶体,吸附溶液中的杂质形成沉淀而析出。
(3)1mol氯气在反应中只能得到1mol电子,生成次氯酸钠。而1mol硝酸铁能失去3mol电子,所以氧化剂和还原剂的物质的量之比是3︰1。


科目:高中化学 来源: 题型:


 右图为该电池和常用的高能碱性
右图为该电池和常用的高能碱性查看答案和解析>>
科目:高中化学 来源:2011届江苏省常州市横山桥高级中学高三上学期期中考试化学 题型:填空题
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
 :
:
|
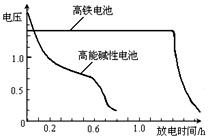
 ,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江宁波万里国际中学高三第一学期期中考试化学试卷(带解析) 题型:填空题
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示: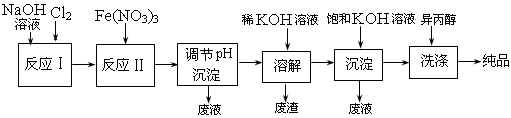
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ; ______ ____。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省九校联合体高三第二次摸底考试理综化学试卷(解析版) 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
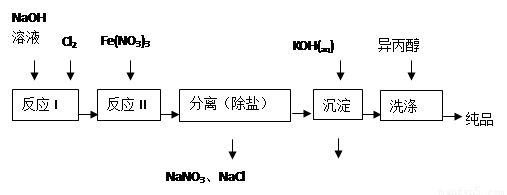
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省常州市高三上学期期中考试化学 题型:填空题
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
①反应I的化学方程式为 ▲ 。
②反应II的离子方程式为 ▲ 。
③加入饱和KOH溶液的目的是 ▲ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ▲ ,____▲______。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 ▲ 。
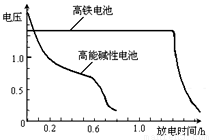
(4)高铁电池是正在研制中的可充电干电池,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com