
分析 (1)根据鉴别溶液和胶体的最简单的方法是丁达尔现象,胶体具有丁达尔现象,而溶液不具有,以此来解答;
(2)铜与氯化铁反应生成氯化铜、氯化亚铁;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,铁先被氧化成亚铁离子,然后是铜被氧化成铜 离子,据此判断;
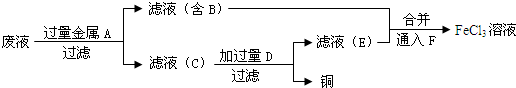
(3)制取的是氯化铁溶液,金属A是铁;滤液B是氯化亚铁溶液;加入的铁过量,滤渣C是铁和铜;制取的是氯化铁,溶解铁,D加入应该是盐酸,据此答题.
解答 解:(1)因FeCl3溶液是溶液,无丁达尔现象,而Fe(OH)3胶体是胶体,有丁达尔现象,所以鉴别FeCl3溶液和Fe(OH)3胶体中最简单有效的是观察是否产生了丁达尔现象(效应),
故答案为:用平行光照射两种分散系(或丁达尔现象);
(2)铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,铁先被氧化成亚铁离子,然后是铜被氧化成铜 离子,所以反应结束后,烧杯底部不可能出现有铁无铜,故选C,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;C;
(3)制取的是氯化铁溶液,金属A是铁;滤液B是氯化亚铁溶液;加入的铁过量,滤渣C是铁和铜;制取的是氯化铁,溶解铁,D加入应该是盐酸,
①滤渣C的化学式为Fe、Cu,故答案为:Fe、Cu;
②加过量盐酸发生反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
③是将亚铁离子氧化成三价铁离子,反应方程式是:2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
点评 本题考查了铁及其化合物的性质,涉及的内容较多,注意分析题中提供的信息,根据所学知识写成反应的方程式,本题难度中等.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下雪时,常用融雪剂清理路面,醋酸钾(CH3COOK)是效果较好的融雪剂。下列关于1mol CH3COOK的叙述正确的是
A.1mol CH3COOK含有1mol钾元素 B.CH3COOK的摩尔质量为98g
C.1mol CH3COOK含有2mol氧  D.1mol CH3COOK约含有3×6.02×1023个H
D.1mol CH3COOK约含有3×6.02×1023个H
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
下列反应中,加入氧化剂才能实现的是( )
A.CO32-→CO2 B.HCl→Cl2 C.Cl2→HCl D.KMnO4→MnO2
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
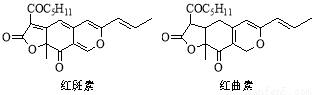
红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如下图所示。
下列说法正确的是
A.红斑素和红曲素互为同分异构体
B.红斑素和红曲素都能与NaOH溶液反应
C.红斑素中含有醚键、羰基等三种含氧官能团
D.1 mol红曲素最多能与6 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的溶液中:Na+、K+、MnO4-、AlO2—
B.滴入酚酞呈无色的溶液中:K+、HCO3-、Cl-、CO32-
C.c(OH-)/c(H+)=1012的溶液中:SO32-、NH4+、NO3-、K+
D.c(I-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,其原子核外共有22种运动状态不相同的电子.金属钛的晶胞结构如图1所示,其堆积方式为六方最密堆积.
,其原子核外共有22种运动状态不相同的电子.金属钛的晶胞结构如图1所示,其堆积方式为六方最密堆积.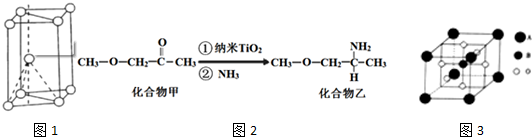
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1 mol Na2O2与足量CO2充分反应,转移的电子数为2NA | |
| D. | 在标准状况下,22.4L由N2、N2O组成的混合气体中所含的氮原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com