
下列关于焰色反应说法不正确的是
A.某些金属的单质和化合物在火焰上灼烧时都能显现特殊的颜色,因此焰色反应是元素的性质。
B.钾的焰色为紫色,必须通过蓝色钴玻璃才能观察到。
C.焰色反应是物理过程,但也可能伴随着化学变化。
D.烟花能显现出五颜六色,与烟花中含有某些金属元素的盐类有关。
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
B | 向氯化钙溶液中通入足量的CO2有 白色沉淀生成 | CaCO3不溶于水 |
C | 1-己醇的沸点比己烷的沸点高 | 1-己醇和己烷可通过蒸馏初步分离 |
D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省分校高三上期中测试理综化学试卷(解析版) 题型:选择题
下列有关物质的分类或归类中正确的是( )
A.化合物:HT、CaCl2、NaOH、盐酸
B.纯净物:水玻璃、胆矾晶体、液氯、硫酸
C.天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D.同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二上10月月考化学卷(解析版) 题型:填空题
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
C+ K2Cr2O7+ H2SO4 ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g) △H1=﹣116kJ•mol﹣1
①已知:2CO(g)+O2(g)=2CO2(g) △H2=﹣566kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g) △H3=﹣484kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
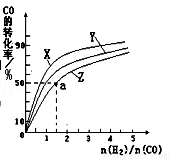
A)在上述三种温度中,曲线Z对应的温度是
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K= .(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L﹣1)变化如下表所示:
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高一上12月月考化学卷(解析版) 题型:选择题
下列反应的离子方程式不正确的是
A.铁与硫酸铜溶液反应:Fe+Cu2+ ═Fe2++Cu
B.硫酸铜溶液与氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH- ═Cu(OH)2↓+BaSO4↓
C.在碳酸氢钠溶液中滴加稀盐酸:H++HCO3- ═CO2↑+H2O
D.铁与稀盐酸反应制取氢气:2Fe+6H+ ═2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:选择题
从下列事实所列出的相应结论正确的是( )
实验事实 | 结论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | SO2通过硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32<AlO2- |
D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上二次月考化学试卷(解析版) 题型:填空题
高温下CuO(s)+CO(g) Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
(1)该反应的平衡常数表达式___________.
(2)在一个容积为2L的密闭容器中,1000℃时加入Cu、 CuO、CO、CO2各0.2 mol,反应经过10min后达平衡。求该时间范围内反应的平均反应速率v(CO2)﹦ 。
(3)以下措施中,能使反应(2)中的正反应速率显著加快同时不影响CO的平衡转化率的是 (填字母序号)。
A、增加CO的浓度 B、增加CuO的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积
(4)1000℃时测得在2L的密闭容器中反应体系中某时刻各物质的物质的量见下表:
CuO | CO | Cu | CO2 |
0.8mol | 0.4mol | 0.6mol | 0.6mol |
此时反应中正、逆反应速率的关系式是 (填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
查看答案和解析>>
科目:高中化学 来源:2016届云南玉溪第一中学高三上学期期中考试理化学试卷(解析版) 题型:填空题
下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:
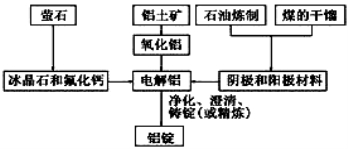
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能x100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com