
| A. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为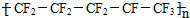 | |
| D. | 四氟乙烯中所有原子均在同一平面内 |
分析 A.CF2=CF2、CH2=CH2的链节分别为:-CF2-CF2-、-CH2-CH2-;
B.四氟乙烯与乙烯生成ETFE、四氟乙烯与六氟丙烯生成聚全氟乙丙烯都是加聚反应;
C.-CF3-中碳原子超过4个价键;
D.乙烯具有平面型结构;
解答 解:A.CF2=CF2、CH2=CH2的链节分别为:-CF2-CF2-、-CH2-CH2-,所以分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式,故A正确;
B.四氟乙烯和乙烯分子中都含有碳碳双键,二者通过加聚反应生成ETFE;四氟乙烯与六氟丙烯都含有碳碳双键,二者通过加聚反应生成全氟乙丙烯,所以两个反应都是加聚反应,故B正确;
C.结构简式中,-CF3-中碳原子超过4个价键,其链节应该为-CF2-CF2-CF(CF3)-或-CF2-CF2-CF(CF3)-CF2-,故C错误;
D.乙烯具有平面型结构,四氟乙烯看作是2个氟原子取代乙烯中的2个氢原子,所有原子在同一个平面,故D正确;
故选C.
点评 本题考查烯烃及卤代烃的加聚反应及产物,题目难度不大,掌握加聚反应的原理是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁、铝 | D. | 烧碱、氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量 | |
| C. | 1 mol H2(g)与1 mol I2(g)完全反应生成 2 mol的HI气体需吸收52 kJ的热量 | |
| D. | 1 mol H2(g)与1 mol I2(g)完全反应放出26 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
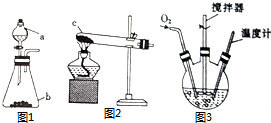 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
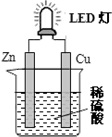
| A. | 锌片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将硫酸换成柠檬汁,导线中就不会有电子流动 | |
| D. | 如果将铜片换成锌片,LED灯仍然会发光 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 若反应物的总能量大于生成物的总能量,则该化学反应为释放能量的反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 若反应X+Y=M是放热反应,该反应一定不用加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )| A. | 构成原电池时b极反应为Cu2++2e-═Cu | |
| B. | 构成电解池时a极质量一定减少 | |
| C. | 构成电解池时b极质量可能减少也可能增加 | |
| D. | 构成的原电池或电解池工作后可能产生大量气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com