
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+HSO3﹣→SO42﹣+Cl﹣+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3﹣在单位时间内物质的量浓度变化表示的该反应V﹣t图.下列说法中不正确的是
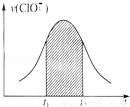
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为V(H+)的V﹣t曲线与图中曲线完全重合
C. 后期反应速率下降的主要原因是反应物浓度减小
D. 图中阴影部分“面积”可以表示t1﹣t2时间为c(Cl﹣)增加
科目:高中化学 来源:2016届吉林省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是
A.该合金中含有铝的质量至少为5.4 g
B.合金中镁的质量分数为63.3%≤Mg%<100%
C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2
D.在产生沉淀后的溶液中有1.6 mol Na2SO4
查看答案和解析>>
科目:高中化学 来源:2016届山东省南校区高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列关于化学基本原理和基本概念的几点认识中正确的是
A、反应的活化能越大,反应速率越快
B、一般认为沉淀离子浓度小于1.0×10-5mol·L-1时,则认为已经沉淀完全
C、由于Ksp(BaSO4)小于Ksp(BaCO3),因此不可能使生成的BaSO4沉淀再转化为BaCO3沉淀
D.不能使酸碱指示剂显色的溶液是中性溶液
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液

A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列有关实验操作或原理正确的是
A.用到金属钠时,要用镊子取、再用小刀切下所需量,剩余的钠不能放回原试剂瓶中
B.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
C.比较不同浓度硫酸与Na2S2O3反应的速率不能通过观察气泡逸出快慢比较,因为SO2易溶于水
D.通过测定等物质的量浓度的NaCl、Na2S溶液的pH,比较硫、氯两种元素的非金属性强弱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:选择题
下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.H2、I2(g)混合气体加压后颜色变深
C.红棕色的NO2加压后颜色先变深再变浅
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高一上10月月考化学试卷(解析版) 题型:选择题
下列有关阿伏加德罗常数(NA)的说法错误的是
A.32 g O2所含的原子数目为NA
B.0.5 mol H2O含有的原子数目为1.5 NA
C.1 mol H2O含有的H2O分子数目为NA
D.0.5 NA个氧气分子的物质的量是0.5 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
下列热化学方程式书写正确的是
A.SO2 + O2  2SO3 ΔH =-196.6 kJ/mol
2SO3 ΔH =-196.6 kJ/mol
B.H2(g)+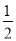 O2(g)= H2O( l ) ΔH =-285.8 kJ/mol
O2(g)= H2O( l ) ΔH =-285.8 kJ/mol
C.2H2 ( g )+ O2 ( g )= 2H2O ( l ) ΔH =+571.6 kJ/mol
D.C(s)+ O2 ( g )= CO2(g) ΔH =+393. 5 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右。
资料:氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味。剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性,是一种重要的化工原料, 用于电镀、冶金和有机合成医药、农药及金属处理方面。
(1)用离子方程式表示其水溶液呈强碱性的原因:
(2)氰化钠要用双氧水或硫代硫酸钠中和。①用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式 ;
②用硫代硫酸钠中和的离子方程式为CN-+S2O32-===A+SO32-,A为 (填化学式)。
(3)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,则非金属性N C(填<,=或>)
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
③用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
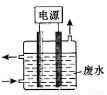
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ ===N2↑ + 2CO2↑ + 5Cl-+H2O
(4)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,也可用于含氰废水的消毒。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
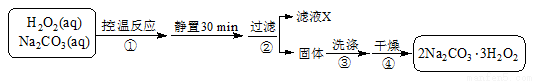
已知:2Na2CO3 (aq)+ 3H2O2 (aq) 2Na2CO3·3H2O2 (s)ΔH < 0,请回答下列问题:
2Na2CO3·3H2O2 (s)ΔH < 0,请回答下列问题:
①下列物质中,不会引起过碳酸钠发生氧化还原反应的有 。
A.FeCl3 B.CuSO4 C.Na2SiO3 D.KCN
②准确称取0.2000g过碳酸钠于250mL锥形瓶中,加50 mL蒸馏水溶解,再加50 mL2.0 mol·L-1 H2SO4,用0.02000mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
[反应6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4 = 3K2SO4 + 6MnSO4 +10Na2SO4 +10CO2 ↑ +15O2↑+34H2O]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com