
【题目】下列性质中,属于烷烃特征性质的是
A.完全燃烧产物只有二氧化碳和水B.几乎不溶于水
C.它们是非电解质D.分子的通式为CnH2n+2,与氯气发生取代反应
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成,下列说法不正确的是( )

A. 1mol CPAE与足量的溴水反应,最多消耗4mol Br2
B. 咖啡酸可发生聚合反应,而且其分子中含有3种官能团
C. 与苯乙醇互为同分异构体的酚类物质共有9种
D. 可用金属Na检测上述反应是否残留苯乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是( )
A. NO B. N2O C. N2O3 D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.苯和乙烯是两种重要的化工原料,都可用来衡量一个国家的化工水平
B.苯和乙烯都易燃烧,燃烧时火焰明亮产生黑烟
C.苯和乙烯都有毒,难溶于水,易溶于有机溶剂
D.苯主要来自于煤的干馏,乙烯主要来自于石油加工
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等。
(1)如下图所示实验,反应的化学方程式为_______________。实验结束后,向试管所得溶液中滴加酚酞溶液,现象是___________________________。
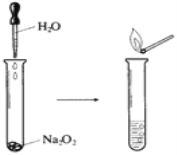
(2)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为______________________。若标准状况下反应生成了5.6LO2,则转移电子的物质的量为______mol。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30%H2O2,反应生成CaO28H2O沉淀;
③经过陈化、过滤,水洗得到CaO28H2O,再脱水干燥得到CaO2。
完成下列填空:
(3)第①步反应的化学方程式为_____________________。
(4)生产中可循环使用的物质是_____________________。
(5)检验CaO28H2O是否洗净的方法是___________。
(6)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(标况),产品中CaO2的质量分数为________(用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com