
| A. | CF4、CCl4、CBr4、CI4的熔点沸点升高与范德华力有关 | |
| B. | H2O的熔、沸点大于H2S的是由于H2O之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 分子晶体中分子一定紧密堆积 |
分析 A、CF4、CCl4、CBr4、CI4都是分子晶体,所以熔点沸点高低与相对分子量的大小有关;
B、水分子间存在氢键,而硫化氢分子间无氢键;
C、乙醇与水都是极性分子;
D、冰中水分子间存在氢键,不具有分子密堆积特征.
解答 解:A、CF4、CCl4、CBr4、CI4都是分子晶体,所以熔点沸点高低与相对分子量的大小有关,而CF4、CCl4、CBr4、CI4的相对分子量逐渐增加同,所以熔点沸点升高,故A正确;
B、水分子间存在氢键,而硫化氢分子间无氢键,所以H2O的熔、沸点大于H2S的熔、沸点,故B正确;
C、乙醇与水都是极性分子,根据相似相溶原理乙醇与水互溶,故C正确;
D、冰中水分子间存在氢键,氢键具有方向性,所以分子晶体冰不具有分子密堆积特征,故D错误;
故选D.
点评 本题考查氢键的存在及对物质性质的影响、相似相溶原理,难度不大,学生在解题中要注意氢键对物质熔沸点的影响.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
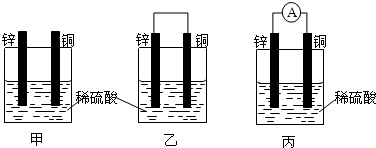
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
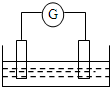 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的元素符号是Cl.
E的元素符号是Cl.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解过程中共转移电子1.4mol | |
| B. | 原硫酸铜溶液的体积为1L | |
| C. | 在这个过程中共生成6.4gCu和0.5molO2 | |
| D. | 电解过程中阴极有0.3molH2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=13的溶液:K+、Na+、Cl-、SiO32- | |
| B. | c(H+)/c(OH-)=1×10-14的溶液:Na+、NH4+、Cl-、SO42- | |
| C. | 0.1mol•L-1的Na2CO3溶液:Na+、Ca2+、I-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:Na+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于(a-0.8 )g | B. | 大于(a-0.8 )g | C. | 大于(a-2.67)g | D. | 等于(a-2.67)g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
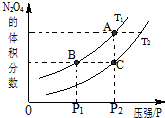 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TNT的制备: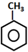 +3HNO3$→_{100℃}^{浓硫酸}$ +3HNO3$→_{100℃}^{浓硫酸}$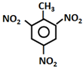 +3H2O +3H2O | |
| B. | 溴乙烷的消去反应:C2H3Br+NaOH$→_{△}^{水}$C2H4↑+NaBr+H2O | |
| C. | 乙醇氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O$?_{△}^{碱性}$CH3C0OH+C2H5OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com