
【题目】某温度下,反应2NO2(g)![]() N2O4(g)在一恒容密闭容器内建立平衡,现向容器内再通入一定量纯净的NO2气体,则建立新平衡后c(NO2)/c(N2O4)的变化趋势是
N2O4(g)在一恒容密闭容器内建立平衡,现向容器内再通入一定量纯净的NO2气体,则建立新平衡后c(NO2)/c(N2O4)的变化趋势是
A. 增大 B. 减小 C. 不变 D. 无法确定
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图装置,试管中盛有的水含几滴酚酞,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象预测错误的是 ( )

A. 气球a被吹大 B. 试管内溶液先变红后褪色
C. U形管内红色退去 D. U形管水位d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们的生活离不开铁元素。从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填化学式)。
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。
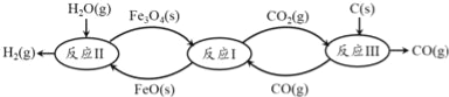
①已知:3FeO(s)+CO2(g)![]() Fe3O4(s)+CO(g)△H1═ —19.3kJmol﹣1
Fe3O4(s)+CO(g)△H1═ —19.3kJmol﹣1
Fe3O4(s)+H2(g)![]() 3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
C(s)+CO2(g)![]() 2CO(g)△H3═ +172.4kJmol﹣1
2CO(g)△H3═ +172.4kJmol﹣1
铁氧化物循环裂解水制氢气总反应的热化学方程式是
C(s)+H2O(g)═H2(g)+CO(g)△H═_____________ 。
②整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。

i.反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H______0(填“>”、“<”或“=”),理由是______。
3Fe(s)+4CO2(g)△H______0(填“>”、“<”或“=”),理由是______。
ii.在低于570℃的某温度时,发生上述反应,增加CO浓度,C(CO)/C(CO2)比值_______(填“增大”“减小”“不变”)。
(3)①18世纪有一个名叫狄斯巴赫的德国人,他是制造和使用涂料的工人,因此对各种有颜色的物质都感兴趣。他实验合成出古老而神奇的蓝色染料普鲁士蓝。他的合成方法如下:
复分解反应ii的化学方程式为______。
②利用普鲁士蓝合成原理也可以用于检测食品中CN﹣,通过试纸变蓝与否则证明食品中含有CN﹣,检测过程方案如下:
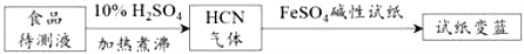
FeSO4碱性试纸用于检测HCN的工作原理为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列方程式:
(1)溴乙烷与氢氧化钠的水溶液共热________________________________。
(2)乙醛与新制的银氨溶液水浴加热________________________________。
(3)纤维素在酸或酶的作用下水解__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①相同质量的SO2、SO3的物质的量之比为________;
②氧原子的个数之比为________。
(2)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
(3)相同条件下10mLA2气体与30mLB2气体恰好完全反应生成20mL某气体C,则C的化学式为__________________(用A、B表示),推断中用到的原理理论是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首台静默移动发电站MFC30 正式问世,MFC30 是基于甲醇重整制氢燃料电池发电技术。已知甲醇制氢方式主要有以下三种:
方法Ⅰ甲醇水蒸气重整制氢:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1= +49.4kJ/mol
CO2(g)+3H2(g) ΔH1= +49.4kJ/mol
方法Ⅱ甲醇氧化重整制氢: CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+ 2H2(g) ΔH2=-192.4 kJ/mol
CO2(g)+ 2H2(g) ΔH2=-192.4 kJ/mol
方法Ⅲ甲醇分解制氢:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)已知CO 的燃烧热△H=-283.0kJ/mol,请结合方法Ⅱ的热化学方程式计算△H3=__________,该反应在_________条件(“高温”,“低温”或“任意温度”下自发进行。
(2)实验室模拟方法Ⅰ制氢,当合成气组成n(CH3OH)∶n(H2O)=1∶1时,体系中甲醇的平衡转化率与温度和压强的关系如图甲所示。

①温度为250℃、压强为P2时,反应达平衡时H2的体积分数为______________________;
②图中的压强由小到大的顺序是___________________,理由是_________________________________。
(3)方法Ⅲ制H2的能量变化曲线如图乙所示。图中由曲线a变化到曲线b应采取的措施是_____________________。恒温恒容时,下列选项能说明该反应达到平衡状态的是___________。
a.v正(CO)=2v逆(H2) b.体系的平均摩尔质量不再改变
c.H2的浓度保持不变 d. △H不再改变
(4)甲醇会对水质造成一定的污染,有一种电化学方法可以消除这种污染,原理是在通电的条件下将酸性溶液中的Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。请写出Co3+去除甲醇的离子方程式______________________________。
(5)MFC30 燃料电池是以氢气为燃料、熔融Li2CO3与K2CO3混合物为电解质的高温型燃料电池,其负极的电极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 物质的实验式就是其分子式
B. 质谱法可以测定物质的相对分子质量
C. 从物质的红外光谱图可以获得分子中含有化学键或官能团的信息
D. 从1H核磁共振谱图可以推知该有机物分子有几种不同类型氢原子及其数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100 mL的NaOH和Ba(OH)2混合碱溶液分成两等份,一份加入过量的Na2SO4溶液,充分反应后得到沉淀2.33 g;另一份加入50 mL0.1 mol/LH2SO4溶液,充分反应后溶液中c(OH-)为0.3 mol/L(此时溶液的体积为100 mL),试计算:
(1)原混合碱溶液中所含Ba(OH)2的物质的量是________。
(2)原混合溶液中NaOH的物质的量浓度是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com