
下列关于化学键的叙述正确的是
A.只有金属元素和非金属元素化合时才能形成离子键
B.单质分子中均存在化学键
C.阴阳离子间通过静电引力而形成的化学键叫做离子键
D.含有共价键的化合物不一定是共价化合物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
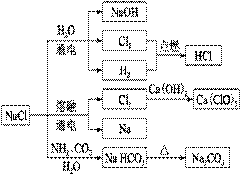
NaCl是一种化工原料,可以制备一系列物质(如右图)。下列说法正确的是
A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
A.K1闭合,铁棒上发生的反应为2H++2e→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
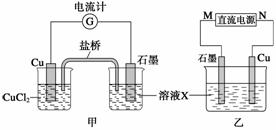
①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
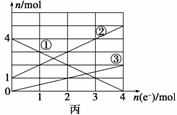
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极; ②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O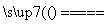 Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.卢瑟福提出了带核的原子结构模型
B.已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,受PM2.5污染的大气不一定能产生丁达尔现象
C.借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有的非金属元素
D.并不是所有金属元素都可以用焰色反应来确定其存在
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合物0.1 mol,完全燃烧得0.16 mol CO2和3.6 g H2O,则混合物中
A.一定有甲烷 B.一定有甲烷和乙烯(C2H4)
C.可能有乙烷(C2H6) D.一定有乙炔(C2H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数变为2a%,此时该H2SO4的物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是
A.c2=2c1 B.c2>2c1 C.c2<2c1 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入250mL 4mol/L的稀硝酸,恰好使混合物完全溶解。放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.21mol B.0.25mol C.0.45mol D.0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com