
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是 、 、 、 。 (2)画出C―和D原子的结构示意图
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为______________________,写出有关离子方程式_________________________________;_________________________________。
(1)镁、铝、氯、碳;
(2) 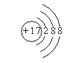 、
、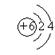 ;
;
(3)观察到先有沉淀生成,后沉淀溶解。
Al3++3OH—===Al(OH)3↓; Al(OH)3+OH—==AlO2—+2H2O
【解析】
试题分析:“0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子”,可知A为ⅡA元素,又“0.4g A的氧化物恰好与100ml
0.2mol/L的盐酸完全反应”,可得关系式: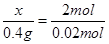 从而求出该氧化物的摩尔质量
从而求出该氧化物的摩尔质量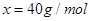 。因此该氧化物为氧化镁,所以A元素为镁元素。“B元素原子核外M层电子数目比K层多1个”可知B元素为铝元素。“C―比A元素的离子多1个电子层”并结合A为镁元素,因此C为氯元素。“D元素的原子核外L层比K层多2个电子”可知C为碳元素。
。因此该氧化物为氧化镁,所以A元素为镁元素。“B元素原子核外M层电子数目比K层多1个”可知B元素为铝元素。“C―比A元素的离子多1个电子层”并结合A为镁元素,因此C为氯元素。“D元素的原子核外L层比K层多2个电子”可知C为碳元素。
(3)“B、C两种元素形成的化合物”的化学式为AlCl3,而苛性钠溶液为NaOH溶液。题干中的题意可转换为“向AlCl3溶液中滴入NaOH溶液”,因此发生反应的化学方程式为:Al3++3OH—===Al(OH)3↓; Al(OH)3+OH—==AlO2—+2H2O。由化学方程式可得出相关的实验现象:即“观察到先有沉淀生成,后沉淀溶解。”
考点:原子结构;铝及其化合物的性质
点评:本题将原子结构与化学反应相结合,是一道综合性较强的题目。但从其考查内容上看,其考查的知识点都是基础知识,对于这类出题形式,考生应加强关注。解题的关键应克服心理障碍,杜绝出现一看到题目就觉得难的心理。


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com