
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
【答案】D
【解析】
定压强相同,比较温度不同时,即比较曲线T1、p2与曲线T2、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应;
定温度相同,比较压强不同时,即比较曲线T1、p1与曲线T1、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以p1<p2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<p;
根据以上分析得出:T1>T2,反应吸热;p1<p2,m+n<p;D项正确,
答案选D。


科目:高中化学 来源: 题型:
【题目】已知:AlO+HCO+H2O=Al(OH)3↓+CO![]() ,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2—)>c(OH) |
B | 0.01 | c(CO32—)+c(HCO3—)+c(H2CO3)=c(AlO2—) |
C | 0.015 | c(Na+)>c(CO32—)>c(OH)>c(HCO3—) |
D | 0.03 | c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+c(OH) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。
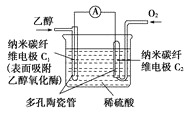
已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+,下列有关说法不正确的是( )
A. C1极为电池负极,C2极为电池正极
B. 电子由C2极经外电路导线流向C1极
C. C2极的电极反应式为O2+4H++4e-=2H2O
D. 该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的分离,实验过程如图所示:
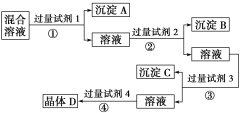
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:
试剂1__,试剂2__,试剂4___。
(2)加入过量试剂3的目的是___。
(3)在加入试剂4后,获得晶体D的实验操作④是___。
(4)写出过程②的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法中正确的( )
A.11.7 g氯化钠晶体溶于水中Na+ 的数目为0.2 NA
B.19.6 g硫酸中含有的氧原子数为0.2 NA
C.标况下,1.12 L水中含有的原子数为0.15 NA
D.0.1mol·L-1的MgCl2溶液中,所含Cl- 的数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
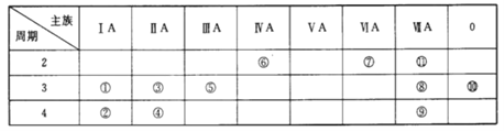
I. (1)化学性质最不活泼的元素是_____(填元素符号,下同),非金属性最强的元素是_____。金属性最强的单质与水反应的离子方程式是________。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是____。
(3)①②③三种元素的原子半径由大到小的顺序是____>____>_____。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,该元素为_____。在这两种盐中该元素的化合价为_____,该元素的最高价氧化物和盐酸反应的离子方程式为_______。向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是_______,有关反应的化学方程式为_______。
II.下列物质:①N2②CO2③NH3④Na2O⑤Na2O2⑥ NaOH ⑦CaBr2⑧H2O2 ⑨NH4Cl⑩Ar
(1)既含有极性键又含有非极性键的是_______;(填序号,下同)
(2)含有非极性键的离子化合物是___________
(3)不含化学键的是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠用途广泛。可广泛应用于医疗、生活、生产中。回答下列问题:
(1)碳酸氢钠能中和胃酸,碳酸氢钠属于____________(填“酸”“碱”“盐”)
(2)碳酸氢钠能与酒石酸配制固体清凉饮料的发泡剂。将发泡剂溶于水发生反应的离子是_________________。
(3)生活中可用碳酸氢钠蒸馒头,用化学方程式解释其原理__________。将碳酸氢钠加入面团中,若理论上生成二氧化碳0.1mol,需要碳酸氢钠的质量是_______克。
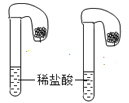
(4)碳酸钠和碳酸氢钠是厨房中常见用品,为鉴别它们,取等质量的样品分别加入如图所示装置的气囊中做对比实验,依据_____________现象,推断哪种样品为碳酸氢钠;写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室制取Fe(OH)3胶体的操作是往____(填序号)中逐滴加入___(填序号),继续煮沸至出现红褐色即停止加热。
①沸水 ②NaOH溶液 ③饱和FeCl3溶液
(2)相应的化学方程式是____。
(3)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是___。
(4)除去胶体中混有的FeCl3和HCl的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油的裂化和裂解可以得到“工业三烯”即乙烯、丙烯、1,3-丁二烯等,最近有科学家发现正丁烷(![]() )脱氢或不完全氧化也可制得1,3-丁二烯(
)脱氢或不完全氧化也可制得1,3-丁二烯(![]() ),已知热化学方程式如下:
),已知热化学方程式如下:
①![]()
![]()
![]()
②![]() =
=![]()
![]()
③![]()
![]()
下列说法正确的是
A.由②可知,正丁烷(![]() )的燃烧热为
)的燃烧热为![]()
B.由①和②可知,同质量的正丁烷(![]() )转变为1,3-丁二烯(
)转变为1,3-丁二烯(![]() )所需要的能量相同
)所需要的能量相同
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)-
Ba(OH)2(aq)-![]() BaSO4(s)+H2O(l)
BaSO4(s)+H2O(l) ![]()
D.由①和②可推知:![]() =
=![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com