
| A. | 原子序数:B>A>D>C | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:A>B,非金属性:C>D | D. | 离子半径:D2->C->B2+>A+ |
分析 A+、B2+、C-、D2-四种离子均具有相同的电子层结构,则有原子序数:B>A>C>D,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期,由电荷可知,A、B为金属元素,C、D为非金属性元素.
同周期自左而右原子半径减小、同主族自上而下原子半径增大,同周期自左而右金属性减弱、非金属性增强,电子层结构相同的离子,核电荷数越大离子半径越小,据此分析.
解答 解:A+、B2+、C-、D2-四种离子均具有相同的电子层结构,则有原子序数:B>A>C>D,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期.
A.A+、B2+、C-、D2-四种离子均具有相同的电子层结构,则有原子序数:B>A>C>D,故A错误;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:A>B>D>C,故B错误;
C.由电荷可知,A、B为金属元素,C、D为非金属性元素,同周期自左而右金属性减弱、非金属性增强,故金属性:A>B,非金属性:C>D,故C正确;
D.核电荷数:D<C<A<B,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:D2->C->A+>B2+,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| B. | 18O2和18O3互为同素异形体,相同状况下其密度之比为2:3 | |
| C. | 过渡元素都是副族元素 | |
| D. | 同主族元素的原子最外层电子数相同,化学性质也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、SO42- | B. | Fe2+、H+、S2-、ClO- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、OH-、NO3-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中共含有11个极性键 | B. | 分子中含有配位键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有1个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元 素 特 征 信 息 |
| A | 最外层电子数是次外层电子数的2倍 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ,E在周期表中的位置为:第三周期第ⅦA族.
,E在周期表中的位置为:第三周期第ⅦA族.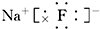 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
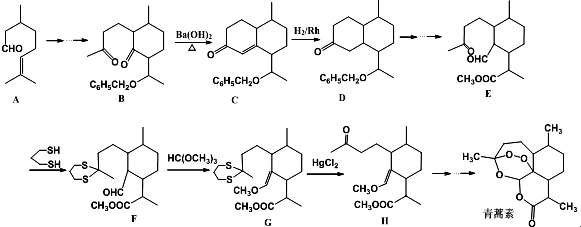
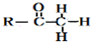 +
+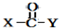 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$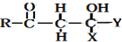
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A<C | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | B的最高价氧化物对应的水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
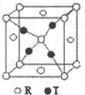 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题: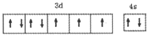 .
.| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com