
【题目】图中的原电池可以测定AgCl的沉淀溶解平衡常数。有关该原电池的说法不正确的是
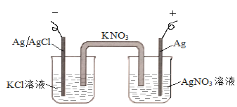
A.负极的电极反应式为:Ag+Cl--e-=AgCl
B.正极的电极反应式是Ag++ e-=Ag
C.电池总反应不是氧化还原反应,不能组成原电池
D.反应时,盐桥中的K+移向AgNO3溶液,NO3-移向KCl溶液
【答案】C
【解析】
左边为负极,电极反应式为:Ag+Cl--e-═AgCl,右边Ag为正极,正极发生还原反应,电极反应式是Ag++e-═Ag,总反应为:Ag++Cl-═AgCl。
A、装置图中,左边为负极,电极反应式为:Ag+Cl--e-═AgCl,A正确,不符合题意;
B、右边Ag为正极,正极发生还原反应,电极反应式是Ag++e-═Ag,B正确,不符合题意;
C、该原电池的总反应为:Ag++Cl-═AgCl,不是氧化还原反应,也能组成原电池,C错误,符合题意;
D、原电池工作时,阳离子向正极移动,阴离子向负极移动,所以盐桥中的K+移向正极AgNO3溶液,NO3-移向负极KCl溶液,D正确,不符合题意;
答案选C。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的![]() 的原子和价电子排布为4s24p5的原子
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
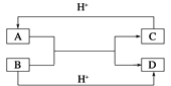
(1)如果A,B,C,D均是10电子的粒子,请写出A,D的电子式:A_______;D_______。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式为__________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于合成氨N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氨气制取尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) ΔH<0
(1)该反应能自自发进行的条件是___________
(2)反应在恒容密闭容器中达到平衡时,下列说法不正确的是________
A.加入催化剂,平衡常数不变
B.容器内的压强不再变化
C.容器内的气体密度不再变化
D.降低温度,平衡向正反应方向移动
(3)某温度下,向容积为10L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。
①该段时间内用NH3表示的平均反应速率为___________
②该温度下此反应平衡常数K的值为________。
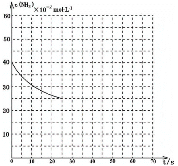
③图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若在25s时保持其它条件不变情况下使用催化剂,使反应延续至70s,请在图中用实线画出25~70s内该反应的进程曲线__________。
(4)尿素在水溶液中会分解,某研究小组分别用三份不同初始浓度的尿素溶液测定分解反应速率,得到c(CO(NH2)2)随时间变化趋势如图所示:
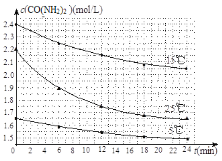
根据图中信息,如何说明分解反应速率随温度升高而增大__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的方法正确的是
A.FeCl3溶液(CuCl2),加入Fe粉,过滤
B.CO2(SO2),通入饱和Na2CO3溶液中
C.NO(NO2),通入水中
D.Na2CO3溶液(Na2SO4),加入过量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车常用蓄电池其结构如图所示,放电时反应如下: PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
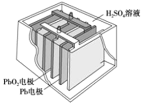
A.Pb 作为负极,失去电子,被氧化
B.电池放电时,溶液酸性增强
C.负极反应是 Pb+SO42-–2e-=PbSO4
D.PbO2 得电子,被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com