
【题目】
(1)有下列四组物质①水、酒精、煤、石油 ②CaO、SO3、SO2、P2O5 ③HNO3、H2SO4、HCl、NaCl ④KClO3、KCl、KMnO4、HgO各组中均有一种物质所属类别与其他物质不同,这四种物质分别是:①;②;③;④。
(2)在标准状况下,1 L水溶解了一定体积的NH3 , 所得溶液的密度为ρ g·cm-3 , 物质的量浓度为a mol·L-1 , 则所溶解的NH3的体积为L。
(3)3.01×1023个OH-的物质的量为mol,质量为g,含有电子的物质的量为mol,含有质子的数目为 , 这些OH-与mol NH3的质量相同.与克Na+含有的离子数相同。
【答案】
(1)煤或水,CaO,NaCl,HgO
(2)![]()
(3)0.5,8.5,5,4.5NA,0.5,11.5
【解析】解:(1)①水、酒精、石油均为液体,而煤为固体,或酒精、煤、石油的主要成分为有机物,而水为无机物,故选水,
所以答案是:煤或水;
②CaO为碱性氧化物,SO3、SO2、P2O5均为酸性氧化物,
所以答案是:CaO;
③HNO3、H2SO4、HCl均为酸,而NaCl属于盐,
所以答案是:NaCl;
④KClO3、KCl、KMnO4均为盐,而HgO属于氧化物,
所以答案是:HgO;
(2)假设氨气的体积为xL,则NH3的物质的量为 ![]() =
= ![]() mol,溶于水配成1L的溶液,所得溶液的质量为
mol,溶于水配成1L的溶液,所得溶液的质量为 ![]() mol×17g/mol+1000g=(
mol×17g/mol+1000g=( ![]() +1000)g,溶液的体积为(
+1000)g,溶液的体积为( ![]() +1000)g÷ρ g·cm-3 =
+1000)g÷ρ g·cm-3 = ![]() cm3=
cm3= ![]() L,物质的量浓度为a mol·L-1=
L,物质的量浓度为a mol·L-1= 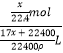 ,解得x=
,解得x= ![]() L,
L,
所以答案是: ![]() L;
L;
(3)OH-的物质的量为 ![]() =0.5mol,其质量为0.5mol×17g/mol=8.5g,含有电子物质的量为0.5mol×1=5mol,OH-、NH3的摩尔质量相等,二者质量相等,则二者物质的量相等,即这些OH-与0.5mol NH3的质量相同,含有质子4.5mol,数目为4.5NA,0.5molNa+的质量为0.5mol×23g/mol=11.5g,
=0.5mol,其质量为0.5mol×17g/mol=8.5g,含有电子物质的量为0.5mol×1=5mol,OH-、NH3的摩尔质量相等,二者质量相等,则二者物质的量相等,即这些OH-与0.5mol NH3的质量相同,含有质子4.5mol,数目为4.5NA,0.5molNa+的质量为0.5mol×23g/mol=11.5g,
所以答案是:0.5;8.5;5;0.5;4.5NA,11.5。


科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480mL0.5molL﹣1 NaOH溶液以备使用. 
(1)该同学应选择mL的容量瓶.使用容量瓶前必须进行的一步操作是
(2)其操作步骤如下图所示,则如图操作应在下图中的(填选项字母)之间.
A.②与③
B.①与②
C.④与⑤
(3)该同学应称取NaOH固体g
(4)下列操作对所配溶液的浓度大小有何影响?用“偏高”“偏低”或“无影响”填空: ①定容时俯视刻度线:;
②摇匀后,液面低于刻度线,没有再加水: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一、如图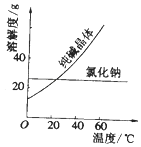
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇( C2H6O2) | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题:
(1)要从氯化钠和纯碱的固体混合物中分离得到纯净的氯化钠,应先将固体溶解,再经过、洗涤、干燥等操作.
(2)将乙二醇和丙三醇相互分离的最佳方法是 , 写出该方法在操作上的注意事项(写出一项) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有A+ , B3+ , C3+ 三种金属阳离子的水溶液发生了如下一系列变化后逐一沉淀出来,其中B3+转入白色沉淀: 
请通过分析回答(用化学符号填写):
(1)A+是 , B3+是 , C3+是;
(2)X是 , Y是 , Z是;
(3)写出下列离子方程式:
①生成Y沉淀:;②B3+与过量氨水反应:;
(4)写出下列化学方程式:单质铝和Y分解后的固体产物反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁片分别放入下列溶液中,铁片溶解,而溶液质量增加,但无气体产生,此溶液是
A.稀硫酸 B.AgNO3溶液 C.Fe2(SO4)3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法正确的是( )
A.实验时冷却水应从a进入,从b流出
B.蒸馏烧瓶中要加入碎瓷片,目的是防止暴沸
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( ) 
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率(填“增大”、“不变”或“减小”,下同).
(2)将容器的体积缩小一半,其反应速率 .
(3)保持体积不变,充入N2使体系压强增大,其反应速率 .
(4)保持压强不变,充入N2使容器的体积增大,其反应速率 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com