
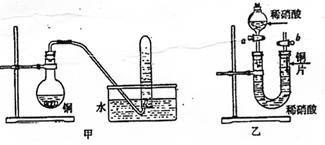
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
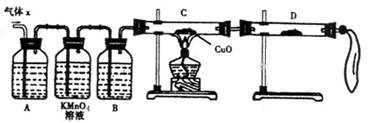
科目:高中化学 来源:不详 题型:实验题
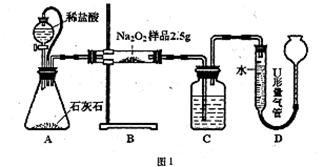
| 滴定次数 | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
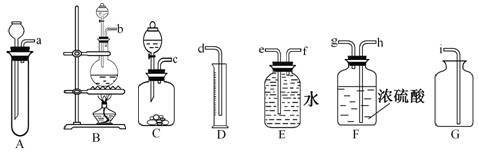
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
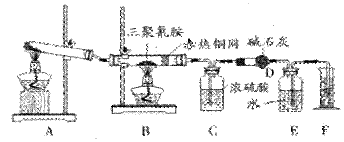

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
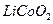 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过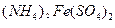 、
、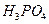 与
与 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。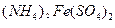 和
和 溶液直接混合的原因是 。
溶液直接混合的原因是 。 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的 的导电性能外,还能 。
的导电性能外,还能 。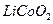 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。
 被氧化成
被氧化成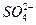 ,
,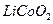 在溶解过程中反应的化学方程式为 。
在溶解过程中反应的化学方程式为 。 在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。
在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
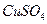 溶液;
溶液;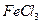 饱和溶液,可以制得
饱和溶液,可以制得 胶体;
胶体; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com