
【题目】甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+ 、Mg2+ 、H+、OH- 、Cl- 、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成,则甲为________(填字母)
A.MgSO4 B.Ba(HCO3)2 C.Mg(HCO3)2 D.Ba(OH)2
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2
CH2===CH2
CH2===CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
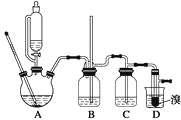
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是___________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,a、b是两根碳棒。以下叙述正确的是

A.a是阴极,发生还原反应
B.b是负极,发生氧化反应
C.滴加酚酞试液,b极附近溶液颜色变红
D.铜片上的电极反应式是:Cu2++2e = Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制一种仅含四种离子(不考虑水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol/L能达到此目的的是
A. ClO-、I-、K+、Na+ B. Na+、Mg2+ 、SO42-、Cl-
C. Al3+ 、K+、SO42-、NO3- D. Ba2+ 、OH-、CO32-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
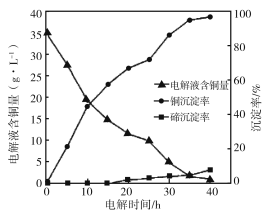
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在某温度T℃时,某稀硫酸和盐酸混合液中,c(H+)=10﹣amolL﹣1,c(OH﹣)=10﹣bmolL﹣1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的质量与加入的Ba(OH)2溶液体积关系如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:

(1)最初混合酸溶液中c(HCl)= ;
(2)图中 点BaSO4就已被完全沉淀,质量为 克;
(3)B点pH= (第(3)步要求写出计算过程)(已知lg3=0.48)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【岳阳市一中2010届高三第四次质检考试】下列说法不正确的是( )
A.根据溶液中c(H+)和c(OH-)的相对大小可以判断溶液的酸碱性
B.根据溶液的导电能力大小可以判断电解质的强弱
C.根据熵变和焓变可以判断化学反应能否自发进行
D.根据化学平衡常数可以判断化学反应进行的限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com