
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
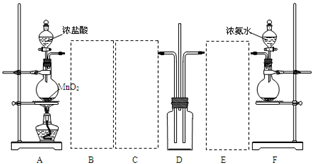
查看答案和解析>>
科目:高中化学 来源: 题型:
| Pt丝灼烧 |
| ① |
| +氯化钡溶液 |
| ② |
| +稀HCl酸化 |
| ③ |
| +稀氨水 |
| ④ |
| +烧碱溶液 |
| ⑤ |
| 吹气 |
| ⑥ |
| A、该无色溶液有可能是明矾溶液 |
| B、这三组实验中,只有(3)是严密合理的 |
| C、步骤④的离子方程式为:Al3++3OH-=Al(OH)3↓ |
| D、步骤⑥的化学方程式为:NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)镁、铝是生活中两种常见的金属,课堂上老师演示了系列关于镁、铝性质的实验,某学习小组在组长的带领下进行归纳整理,并进行了深入的思考。
(1) “位置和结构”
①铝元素在周期表的位置是 镁原子电子式
(2) “基本性质”
②下列关于镁、铝及其化合物性质的说法,正确的是 (不定项选择)
A.镁在氯气中剧烈燃烧,产物中只有离子键
B.电解熔融的Al2O3可以制备金属铝
C.Al和MgO按照适当比列混合可做“铝热剂”,发生“铝热反应”
D.铝片放入冷的浓硝酸中,无明显现象,未发生化学反应
(3)设计实验验证“金属性:Mg > Al”
实验一:截取一段大小和形状相同的“经过一定预处理”的镁片和铝片,放入试管中,同时加入浓度和体积均相同的盐酸,观察某种实验现象,得到结论“金属性:Mg> Al”
③镁片和铝“经过一定预处理”,下列实验操作达到“预处理”效果的是
A.用砂纸打磨镁片和铝片
B.用盐酸浸泡镁片和铝片片刻
C.用烧碱溶液浸泡镁片和铝片片刻
④ 通过观察某种实验现象得到结论,该实验现象是
实验二:如右图,甲乙试管中分别加入2ml 1mol/L MgCl2和AlCl3溶液,用胶滴管逐滴滴加5mol/L NaOH溶液至过量。
⑤该“对照实验”甲、乙试管中分别出现实验现象能得出“金属性:Mg> Al”
甲试管现象
乙试管离子方程式
实验三:利用原电池原理也可得出“金属性:Mg> Al”,
⑥请在右框中画出一个原电池装置图,能够通过观察实验现象判定金属性:Mg>Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
查看答案和解析>>
科目:高中化学 来源:2010年广州市执信中学等四校联考高一第二学期期末考试化学试题 题型:实验题
(15分)镁、铝是生活中两种常见的金属,课堂上老师演示了系列关于镁、铝性质的实验,某学习小组在组长的带领下进行归纳整理,并进行了深入的思考。
(1) “位置和结构”
①铝元素在周期表的位置是 镁原子电子式
(2) “基本性质”
②下列关于镁、铝及其化合物性质的说法,正确的是 (不定项选择)
A.镁在氯气中剧烈燃烧,产物中只有离子键
B.电解熔融的Al2O3可以制备金属铝
C.Al和MgO按照适当比列混合可做“铝热剂”,发生“铝热反应”
D.铝片放入冷的浓硝酸中,无明显现象,未发生化学反应
(3)设计实验验证“金属性:Mg > Al”
实验一:截取一段大小和形状相同的“经过一定预处理”的镁片和铝片,放入试管中,同时加入浓度和体积均相同的盐酸,观察某种实验现象,得到结论“金属性:Mg > Al”
③镁片和铝“经过一定预处理”,下列实验操作达到“预处理”效果的是
A.用砂纸打磨镁片和铝片
B.用盐酸浸泡镁片和铝片片刻
C.用烧碱溶液浸泡镁片和铝片片刻
④通过观察某种实验现象得到结论,该实验现象是
实验二:如右图,甲乙试管中分别加入2ml 1mol/L MgCl2和AlCl3溶液,用胶滴管逐滴滴加5mol/L NaOH溶液至过量。
⑤该“对照实验”甲、乙试管中分别出现实验现象能得出“金属性:Mg > Al”
甲试管现象
乙试管离子方程式
实验三:利用原电池原理也可得出“金属性:Mg > Al”,
⑥请在右框中画出一个原电池装置图,能够通过观察实验现象判定金属性:Mg >Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com