
分析 ①铜粉中混有少量的氧化铜,加盐酸溶解,过滤;
②硝酸中混有少量的硫酸,加硝酸钡,过滤;
③氢氧化钠中混有少量的碳酸钠,加入氢氧化钙,再过滤;
④氧化钙中混有少量的碳酸钙,碳酸钙在高温下分解生成CaO和二氧化碳;
⑤硫酸钠中混有少量的氧化钠,加稀硫酸溶解,再蒸发结晶.
解答 解:①铜粉中混有少量的氧化铜,加盐酸溶解,过滤,得到Cu,CuO与盐酸反应生成氯化铜和水,其反应的化学方程式:CuO+2HCl=CuCl2+H2O;
故答案为:CuO+2HCl=CuCl2+H2O;
②硝酸中混有少量的硫酸,加硝酸钡生成硫酸钡沉淀和硝酸,过滤得到硝酸溶液,其反应的化学方程式为:Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;
故答案为:Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;
③氢氧化钠中混有少量的碳酸钠,加入氢氧化钙,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,再过滤,得到氢氧化钠,反应的方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
故答案为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
④氧化钙中混有少量的碳酸钙,碳酸钙在高温下分解生成CaO和二氧化碳,反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
⑤硫酸钠中混有少量的氧化钠,加稀硫酸溶解,氧化钠与硫酸反应生成硫酸钠和水,再蒸发结晶,得到硫酸钠固体,其反应的方程式为Na2O+H2SO4=Na2SO4↓+H2O;
故答案为:Na2O+H2SO4=Na2SO4↓+H2O.
点评 本题考查物质的分离提纯方法、化学方程式的书写,题目难度不大,注意把握常见物质的分离提纯方法以及物质性质,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
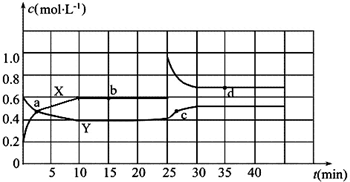
科目:高中化学 来源: 题型:推断题
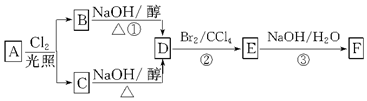
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
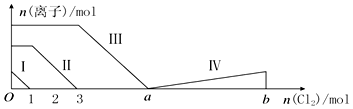
| A. | 线段Ⅱ表示Br-的变化情况 | |
| B. | 线段Ⅳ表示IO3-的变化情况,其中IO3-增加了5moL. | |
| C. | a=6 | |
| D. | 原溶液中n(FeI2):n(FeBr2)=3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2,则平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 地下钢管连接锌板 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com