
甲醛(H2C=O)在Ni催化作用下加氢可得到甲醇(CH3OH),以下说法中正确的是
A.甲醇、甲醛分子间都可以形成氢键
B.甲醇分子内C原子采取sp2杂化,O原子采取sp杂化
C.甲醛为极性分子,分子中两个C—H键夹角小于120°
D.甲醇分子内的O—C—H键角大于甲醛分子内的O—C—H键角
科目:高中化学 来源:2015-2016学年宁夏银川二中高二下期中化学试卷(解析版) 题型:填空题
有机物A可以通过不同的反应得到B和C:
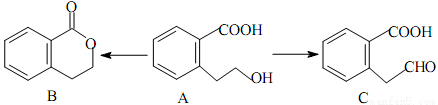
(1)A的分子式为_________________,C的含氧官能团名称为_________________。
(2)A制取C的有机反应类型为_________________;A制取B的化学方程式为:_________________。
(3)A发生消去反应后产物的结构简式为_________________,A分子中一定共面的碳原子有_________________个。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:填空题
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的△H__________0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)=0.003mol•L-1•s-1,则6S末CO2的物质的量浓度为__________;反应经一段时间后,达到平衡后CO的转化率为__________;
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O):c(CO)应不低于__________;
(5)已知CO可用于制备很多物质:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ•mol-1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-556.0kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
请写出S(g)与O2(g)反应生成SO2(g)热化学方程式_______________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:填空题
Ni和Fe在工业生产和新型材料领域有广泛的应用,黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制硫酸;回答下列问题:
(1)将FeS2与稀盐酸所对应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________;
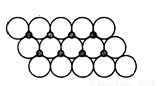
(2)FeS2的晶体中的Fe2+离子的排列方式如下图所示:

①每个Fe2+周围最近的等距离的S22-离子有________个;
②已知FeS2的晶胞参数是a0=54nm,它的密度为_____________g•cm-3;(列式并计算,阿伏加德罗常数为6.02×1023)。
(3)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为___________(用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为________g(氧离子的半径为1.40×10-10m,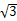 =1.732)。
=1.732)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
某原子的价电子构型为3s23p2,其核外电子运动说法错误的是
A.有4种不同的伸展方向 B.有5种不同能量的电子
C.有5种不同的运动范围 D.有14种不同运动状态的电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
下面的排序正确的是
A.硬度由大到小:金刚石>碳化硅>晶体硅
B.熔点由高到低:SiC>Si>SiO2>Ge
C.沸点由高到低:NH3>PH3>AsH3>SbH3
D.晶格能由大到小:NaI>NaBr>NaCl>NaF
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三下第四次模拟理综化学试卷(解析版) 题型:简答题
【化学---选修2:化学与技术】水是生命之源,水的品质对于健康有着十分重要的意义。化学兴趣小组对某山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加 后加 ,原因是 。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8% 溶液中再生。
(4)海水淡化是获得淡水的重要来源。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、S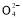 等离子,电极为惰性电极。请分析下列问题:
等离子,电极为惰性电极。请分析下列问题:

①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式 。阴极区的现象是: 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、Fe2+、Al3+、SO42-、Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量的硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
A.反应后,溶液中NH4+、Fe2+、SO42-的物质的量减少,而Al3+、Cl-的物质的量不变
B.Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化
C.该实验中共有二种气体生成
D.Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一平行班下期中化学试卷(解析版) 题型:选择题
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )

A.Cu是原电池的负极
B.Al是原电池的负极
C.电子由Al沿导线流向铜
D.铝片上的电极反应式为:Al﹣3e﹣═AL3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com