
| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量为______g. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施:______. |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施:______. |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: ______. |
| 0.2mol/L×0.01L |
| 0.1L |


科目:高中化学 来源: 题型:
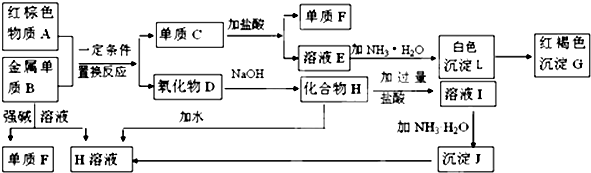
 (2008?驻马店二模)如图是中学化学中常见物质间的反应转化关系,其中部分产物已略去.常温下,G为固体单质,B、I液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C,H可用作工业冶炼金属的还原剂.
(2008?驻马店二模)如图是中学化学中常见物质间的反应转化关系,其中部分产物已略去.常温下,G为固体单质,B、I液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C,H可用作工业冶炼金属的还原剂.
| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量为 2.9 2.9 g. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒搅拌 用玻璃棒搅拌 . |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: 用玻璃棒引流 用玻璃棒引流 . |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: 改用胶头滴管加水至刻度线 改用胶头滴管加水至刻度线 . |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
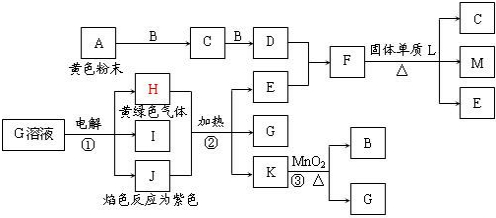
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com