
科目:高中化学 来源:不详 题型:实验题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 仪 器 及 装 置 | 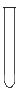 | 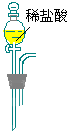 | 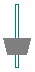 | 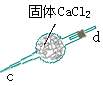 |  | 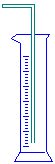 | 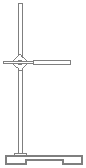 |
 CO3样品中的NaHCO3分解放出的二氧化碳的体积。
CO3样品中的NaHCO3分解放出的二氧化碳的体积。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 实验次数 | 样品质量/g | 沉淀质量/g |
| 1 | 1.716 | 2.758 |
| 2 | 2.574 | |
| 3 | 3.432 | 5.516 |
| 4 | 4.290 | 5.516 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.试管外壁发热 | B.溶液最后变为蓝色 |
| C.溶液先变蓝最后退色 | D.有气泡冒出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.7.2 g | B.4.2 g | C.2.1 g | D.3.6 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.该溶液的物质的量浓度: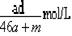 |
B.所得气体体积一定为44. 8a L 8a L |
C.该溶液的质量分数: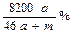 |
| D.向溶液中通入过量CO2,未见白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 晶体配制500mL0.05mol/L的
晶体配制500mL0.05mol/L的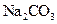 溶液,请回答下列问题:
溶液,请回答下列问题: 晶体_______g。
晶体_______g。 晶体是__________g。
晶体是__________g。 偏低”、“不变”。):
偏低”、“不变”。): 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
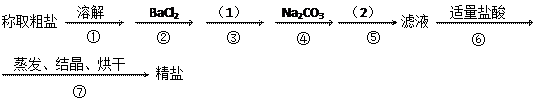
 ②和④可否颠倒_
②和④可否颠倒_ ___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________; 操作⑤,将对实验
操作⑤,将对实验 结果产生影响,其原因是:
结果产生影响,其原因是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com