
| A. |  | B. | H+[O]2-H+ | C. | Na+[Cl]- | D. | Mg2+[F]$_2^-$ |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe2O3与氢碘酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L CCl4分子数目为0.1NA | |
| B. | 物质的量浓度为0.25mol/L的MgCl2溶液中,含有Cl-个数为0.5NA | |
| C. | 6.4g O2和O3的混合物中含有的氧原子数目为0.4NA | |
| D. | 用含3.01×1023个FeCl3的饱和溶液制备出的氢氧化铁胶体数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以碳棒为两极电解氢氧化钠溶液 | B. | 向稀盐酸中滴加NaOH溶液 | ||
| C. | 以碳棒为两极电解饱和氯化钠溶液 | D. | 向氢氧化钠溶液中加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
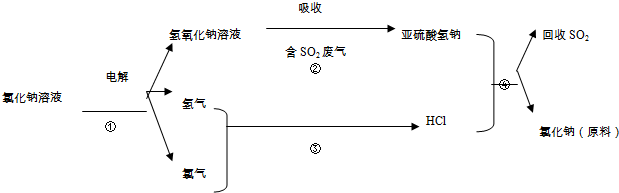
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
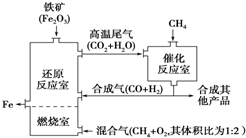
| A. | 加入铁矿石时,将铁矿石粉碎,目的是加快反应速率提高原料利用率 | |
| B. | 增大催化反应室的压强,甲烷的转化率增大 | |
| C. | 设置燃烧室的目的是产生CO2和水蒸气作原料气与甲烷反应 | |
| D. | 催化反应室需维持在550~750℃,目的仅是提高CH4转化的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com