
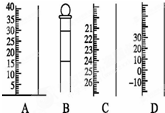
 (1)下列描述:A.用托盘天平称量5.20gNaCl 固体
(1)下列描述:A.用托盘天平称量5.20gNaCl 固体

科目:高中化学 来源: 题型:阅读理解
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) | 平衡时NH3百分含量 |
| ⅰ | 450 | 1/3 | 1 | |
| ⅱ | ① | 1/3 | ② | |
| ⅲ | 480 | 1/3 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
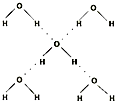
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 | 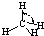 |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 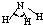 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 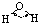 |
104.5° | 水 | 0.0 | 100.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.a>c>b>d B.a>c>d>b
C.a>b>c>d D.d>b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com