
| A、Al、CuSO4、Na[Al(OH)4] | B、NaClO、Na2SO3、BaCl2 | C、KNO3、NaCl、NaHCO3 | D、NaNO3、FeSO4、NH4HCO3 |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源:物理教研室 题型:022
A.滴定管要先用试液润洗两遍,而容量瓶却不能先用试液润洗。
B.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛。
C.配制稀硫酸时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸。
D.盛放碱液的试剂瓶要用橡皮塞,而不能用玻璃塞。
E.在试液中加足量稀盐酸时无沉淀生成,再加BaCl2溶液后有白色沉淀,可确定该试液中有SO![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:022
下列说法正确的是(填写标号)________。
A.滴定管要先用试液润洗两遍,而容量瓶却不能先用试液润洗。
B.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛。
C.配制稀硫酸时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸。
D.盛放碱液的试剂瓶要用橡皮塞,而不能用玻璃塞。
E.在试液中加足量稀盐酸时无沉淀生成,再加BaCl2溶液后有白色沉淀,可确定该试液中有SO![]() 。
。
查看答案和解析>>
科目:高中化学 来源:0116 会考题 题型:实验题

查看答案和解析>>
科目:高中化学 来源:河北省期末题 题型:实验题

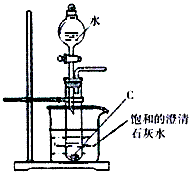
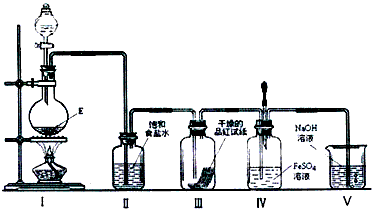
查看答案和解析>>
科目:高中化学 来源:0117 模拟题 题型:计算题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com