
进行化学实验时必须注意安全,下列说法不正确的是( )
①不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛;
②不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
③不慎将浓盐酸洒在桌面上,应立即用浓氢氧化钠溶液冲洗;
④配制稀硫酸时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑤酒精灯着火时可用水扑灭.
A.①②③ B.②③④ C.③④⑤ D.全部.
考点:
化学实验安全及事故处理..
专题:
实验评价题.
分析:
从实验操作的基本要求和实验事故的处理方法等方面回答.
解答:
解:①不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛,故①正确;
②不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液,故②正确;
③浓氢氧化钠溶液具有强烈的腐蚀性,故③错误;
④稀释浓硫酸时放热将影响量筒的准确度甚至发生炸裂,量筒不能用来配制溶液,配制稀硫酸时,应先在烧杯中加一定量的水,再向水中加入浓硫酸,边加边搅拌,故④错误;
⑤水的密度大于酒精,若用水灭火则酒精在水的上层会继续燃烧,酒精着火应用沙子或湿布盖灭(隔绝空气),故⑤错误;
故选:C.
点评:
本题考查了化学实验安全以及事故处理方法,题目难度不大,掌握化学实验时常见意外事故的处理方法是解题关键.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
已知A(g)+B(g)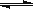 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ▲ ,△H ▲ 0(填“<”“ >”“ =”);
(2) 830℃时,向一个 5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。,则6s时c(A)= ▲ mol·L-1,C的物质的量为 ▲ mol;反应经一段时间后达到平衡,此时A的转化率为 ▲ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ▲ ;
(3)判断该反应是否达到平衡的依据为 ▲ (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成C和A的物质的量相等
(4)1200℃时反应C(g)+D(g)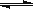 A(g)+B(g)的平衡常数的值为 ▲ 。
A(g)+B(g)的平衡常数的值为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质或应用的说法正确的是( )
A.在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化
B.用核磁共振氢谱鉴别1—丙醇和2—丙醇
C.间二溴苯仅有一种空间结构可证明 苯分子中不存在单双键交替的结构
苯分子中不存在单双键交替的结构
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
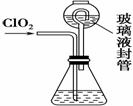

(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O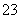 = 2I-+S4O
= 2I-+S4O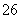 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO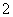 。2001年我国卫生部规定,饮用水的ClO
。2001年我国卫生部规定,饮用水的ClO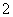 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO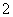 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol氧的质量是16g•mol﹣1 | B. | Na+的摩尔质量是23g•mol﹣1 |
|
| C. | CO2的摩尔质量是44g | D. | 氢的摩尔质量是2g•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为某市售盐酸试剂瓶标签上的部分数据.则该盐酸的物质的量浓度是( )
| 盐酸 化学式:HCl 相对分子质量:36.5 密度:1.18g/cm3 HCl的质量分数:36.5% 符合GB622﹣89 |
|
| A. | 3mol/L | B. | 8.4mol/L | C. | 11.8mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
钠铝合金(常温液态)可作为核反应堆的载热介质。下列说法正确的是
A该合金的熔点高于金属钠的熔点
B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Al)>n(Na)
C.若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成
D.等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中的实验操作能达到实验目的或能得出相应结论的是
| 选项 | 实验内容 | 实验目的或实验结论 |
| A | 向盛有2 mL 0.1 mol/L AgNO3溶液的试管中滴加5滴0.1 mol/L NaCl溶液,有白色沉淀生成,再向其中滴加5滴0.1 mol/L KI溶液 | 说明一种沉淀能转化为溶解度更小的沉淀 |
| B | 向1 mL 20% 的蔗糖溶液中加入3~5滴稀硫酸,水浴加热5 min,冷却后再加入新制Cu(OH)2悬浊液,加热 | 证明蔗糖能发生水解反应[m] |
| C | 水浴加热浓硝酸、浓硫酸和苯的混合物后,直接蒸馏分液后得到的粗产品 | 制备纯硝基苯 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com