
【题目】取Na2CO3和NaOH的混合液100mL,先向其中滴加Ba(OH)2溶液至不产生沉淀为止,再向其中滴加稀盐酸至沉淀消失,产生的沉淀的质量与消耗盐酸的体积如图所示:
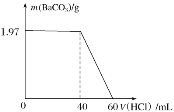
(1)原混合液中Na2CO3与NaOH的物质的量浓度比为___。
(2)稀盐酸的物质的量浓度为___mol·L-1。
【答案】1:2 1
【解析】
在100mL Na2CO3和NaOH的混合液中滴加Ba(OH)2溶液至不产生沉淀为止,此时混合液中含有BaCO3沉淀和NaOH,再滴加稀盐酸至沉淀消失,其中前40mL盐酸中和NaOH,后20mL盐酸溶解BaCO3沉淀,结合原子守恒和电荷守恒即可解题。
(1)设原混合液中Na2CO3的物质的量为amol,NaOH的物质的量为bmol,则滴加滴加Ba(OH)2溶液至不产生沉淀为止时溶液中总NaOH的物质的量为(2a+b)mol;BaCO3的质量为1.97g,物质的量为![]() =0.01mol,由图示可知,20mL盐酸能溶解0.01molBaCO3,根据BaCO3+2H+=Ba2++H2O+CO2↑可知,20mL盐酸含n(HCl)=0.02mol, 故:2a=0.02、2a+b=0.04,解得:a=0.01,b=0.02,则原混合液中Na2CO3与NaOH的物质的量浓度比为0.01:0.02=1:2;
=0.01mol,由图示可知,20mL盐酸能溶解0.01molBaCO3,根据BaCO3+2H+=Ba2++H2O+CO2↑可知,20mL盐酸含n(HCl)=0.02mol, 故:2a=0.02、2a+b=0.04,解得:a=0.01,b=0.02,则原混合液中Na2CO3与NaOH的物质的量浓度比为0.01:0.02=1:2;
(2)盐酸的浓度为![]() =1mol/L。
=1mol/L。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中的26Al和10Be两种元素的比例确定“北京人”年龄,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)写出Be的核外电子排布式_______________。Be所在的周期中,最外层有2个未成对电子的元素的符号是_______、_________。
(2)写出Al的最外层电子轨道表示式__________________。铝原子核外有_______种运动状态不同的电子;铝原子核外有_______中能量不同的电子。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序_________________________;这3种元素最高价氧化物对应的水化物中酸性最强的是___________(写化学式)。
(4)铝元素最高价氧化物与氢氧化钠溶液反应的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中不正确的是( )
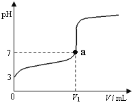
A. 上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B. 图中V1 <20 mL
C. a点对应的溶液中:c (CH3COO-)=c (Na+)
D. 当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B. c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中的 c(H+)/c(CH3COOH) 比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)______(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 | K1=1.54×10-2 K2=1.02×10-7 |
①下列微粒可以大量共存的是______![]() 填字母
填字母![]() 。
。
a.CO32-、HSO3- b.HCO3-、HSO3-
c.SO32-、HCO3- d.CO32- 、H2CO3
②写出下列反应的离子方程式:
H2SO3+Na2CO3(少量):_______________
室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
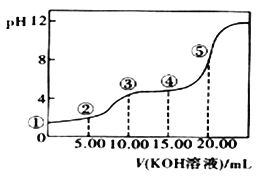
(5)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=_____mol/L。点⑤所示的溶液中各离子浓度的大小顺序_____.
(6)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于锥形瓶中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是_______;该过程中发生反应的离子方程式为________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制造一次性医用口罩的原料之一丙烯是三大合成材料的基本原料,丙烷脱氢作为一条增产丙烯的非化石燃料路线具有极其重要的现实意义。丙烷脱氢技术主要分为直接脱氢和氧化脱氢两种。
(1)根据下表提供的数据,计算丙烷直接脱氢制丙烯的反应C3H8(g)![]() C3H6(g) +H2(g)的H=___。
C3H6(g) +H2(g)的H=___。
共价键 | C-C | C=C | C-H | H-H |
键能/(kJmol-1) | 348 | 615 | 413 | 436 |
(2)下图为丙烷直接脱氢制丙烯反应中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中压强分别为1×104Pa和1×105Pa)
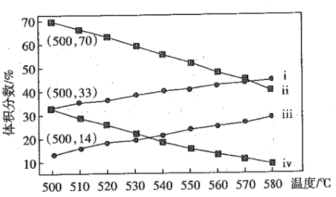
①在恒容密闭容器中,下列情况能说明该反应达到平衡状态的是__(填字母)。
A.H保持不变
B.混合气体的密度保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内生成1molH-H键,同时生成1molC=C键
②欲使丙烯的平衡产率提高,下列措施可行的是____(填字母)
A.增大压强 B.升高温度 C.保持容积不变充入氩气
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,其目的是_____。
③1×104Pa时,图中表示丙烷和丙烯体积分数的曲线分别是___、____(填标号)
④1×104Pa、500℃时,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,计算结果保留两位有效数字)
(3)利用CO2的弱氧化性,科学家开发了丙烷氧化脱氢制丙烯的新工艺,该工艺可采用铬的氧化物作催化剂,已知C3H8+CO2(g) C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。
C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子组成为C9H12苯的同系物,已知苯环上只有一个取代基,下列说法中正确
A.该有机物不能发生加成反应,但能发生取代反应
B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C.该有机物分子中的所有原子可能在同一平面上
D.该有机物的一溴代物最多有6种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W原子提供),下列说法还正确的是( )
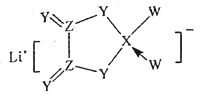
A.气态氢化物的稳定性:W>Y
B.原子半径:X>Z>Y>W
C.该物质中含离子键和共价键
D.Z有多种单质,且硬度都很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种无色液体,有刺激性、窒息性恶臭。人们使用它作橡胶的低温硫化剂和黏结剂。向熔融的硫中通入限量的氯气即可生成S2Cl2,进一步氯化得SCl2。
S2Cl2、SCl2、S的某些性质如下:

实验室可用如图所示装置制备少量S2Cl2。
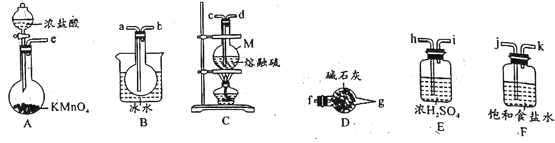
(1)仪器M的名称是__。
(2)实验室中用高锰酸钾与浓盐酸制取Cl2的化学方程式为__。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为e→__→f(按气体流出方向)。D装置中碱石灰的作用是_。
(4)S2Cl2粗品中可能混有的杂质是__(填化学式),从S2Cl2粗品中提纯S2Cl2的操作方法是__(填操作名称)。.
(5)若产物S2Cl2中混入少量水,则发生反应的化学方程式为__。
(6)对提纯后的产品进行测定:取mg产品,加入50mL水充分反应(SO2全部逸出),过滤,洗涤沉淀并将洗涤液与滤液合并,用100mL容量瓶定容,取20.00mL溶液与浓度为0.4000mol·L-1的硝酸银溶液反应,消耗硝酸银溶液20.00mL,则产品中氯元素的质量分数为__(用含有m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入A(体积不变)时混合物的颜色________,加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______(填“变浅”“变深”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com