
研究硫及其化合物对于工农业生产具有重要意义。
(1)图Ⅰ所示一个容积为4L的密闭容器,内有可移动的隔板。一定温度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化剂存在下分别发生反应:
左室:
右室:
反应达到平衡时,右室反应过程和能量关系如图Ⅱ所示。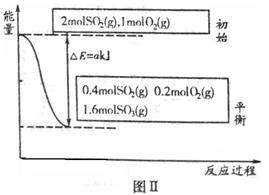
①ΔH2=_______(含a的数学式表示);反应的平衡常数K=_________L·mol-1。
②能说明两边反应一定达到平衡的是______________(填序号)。
A.隔板不再移动
B.左右两边SO2的物质的量相等
C.左右二室中SO2与O2物质的量之比都是2∶1
③达平衡时,左室反应吸收的热量为Q1kJ,右室反应吸收的热量为Q2kJ,则Q1、Q2满足的关系是_____________(填序号)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高温下,炽热的Cu2S与水蒸气反应生成金属铜、H2和SO2(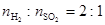 )。
)。
①写出该反应的化学反应方程式_____________________________________________。
②若有1 mol Cu2S参与反应,则转移电子的物质的量是_________mol。
(1)①-1.25a kJ/mol 160
② AB ③ C
(2)①Cu2S+2H2O 2Cu+ 2SO2 + H2 ②6
2Cu+ 2SO2 + H2 ②6
解析试题分析:(1)①由图Ⅱ可以得出,反应物2molSO2平衡时为0.4mol,反应了1.6mol产生akJ的热量,故该反应的△H2=-2a/1.6=-1.25a kJ/mol相同条件下,左右室反应为等效平衡,达到平衡后两边体积相等为2L,
K=c2(SO3)/ c2(SO2) c(O2)=0.82/(0.22×0.1)=160
②A、该反应方程式两边化学计量数和不等,平衡移动会导致气体体积变化,隔板不动,即说明反应达到平衡,正确;B、两边是等效平衡,平衡后完全相同,若不相等则没有达到平衡,正确;C、加入的量是比是2∶1,反应的量为比也是2∶1,所以任何时间左右二室中SO2与O2物质的量之比都是2∶1,错误。
③平衡状态时SO3的物质的量为1.6mol,显然左室反应的量少,吸收的热量比右室反应的放出的热量少,所以Q1<Q2
(2)①该反应化学方程式为Cu2S+2H2O 2Cu+ 2SO2 + H2 ②6
2Cu+ 2SO2 + H2 ②6
考点:考查STS中环境保护有关问题。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1 mol含硫产物的数据)。
(1)写出表示S8燃烧热的热化学方程式_____________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________。
(3)若已知SO2中硫氧键的键能为d kJ·mol-1,O2中氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)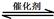 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L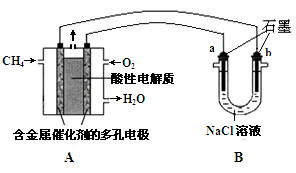
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。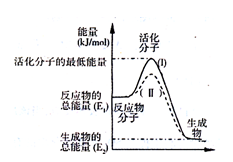
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮及其化合物在工农业生产、生活中有者重要作用。请回答下列问题: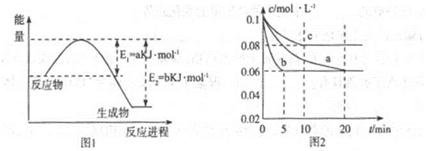
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能星变化示意图(a、b均大于0,)且知:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ·mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式____________;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1,c(H2)=0.3mol·L-1;合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①计算在a达平衡时H2的转化率为______;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是______;
试写出判断b与a条件不同的理由____________;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如下表:
①试确定K1的相对大小,K1______4.1x106(填写“>”“-”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的 是______(填序号字母)。
A.容器内NH3的浓度保持不变 B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 )______。
②250C时,将pH=x氨水与pH=y的疏酸(且x+y=14,x>11)等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.[SO42-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[SO42-]>[OH-]>[H+]
C.[NH4+]+[H+]>[OH-]+[SO42-]
D.[NH4+]>[SO42-]>[H+]>[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用海水资源进行化工生产的部分工艺流程如图: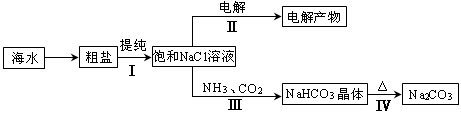
(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。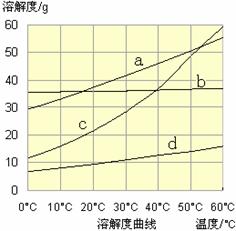
(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2=" +473.63" kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下: 
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。
(3)NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线见图。
①由图可以看出,脱硝工艺流程应在 (填“有氧”或“无氧”)条件下进行。
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是 。
(4)NO2也可用尿素[CO(NH2)2]还原,写出尿素与NO2反应的化学方程式: 。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图11。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。若生成1molY,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol 请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量。写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com