
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 |  | Zn+Fe2+=Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | | Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
| ④ | |  | | Fe3+具有氧化性 |
| A.Cl2 | B.Na | C.Na+ | D.Cl- E.SO2 F.NO2 |
科目:高中化学 来源:不详 题型:实验题
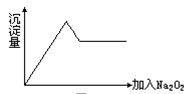 ⑦……。
⑦……。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应)。
高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应)。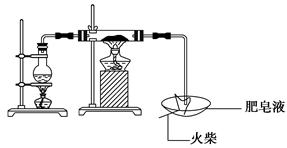
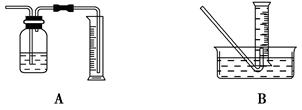
| A.100 mL | B.200 mL |
| C.500 mL | D.1 000 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.残余固体全部是铜 | B.残余固体可能为铁和铜的混合物 |
| C.残余固体是铁,溶液中一定不含Cu2+ | D.最后得到的溶液可能含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Fe3+ | B.Fe2+、Fe3+ | C.Cu、Cu2+ | D.Cu、Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2c1V1=c2V2 | B.反应产生氢气的质量m(H2)= 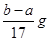 |
| C.b≤a+17c2V2 | D.合金中含镁的质量分数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②⑤ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

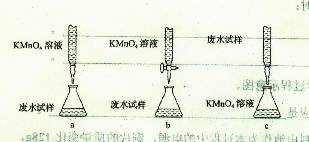
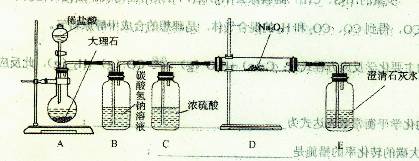
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色 |
| B.向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色 |
C.向Fe(NO3) 2溶液中滴加稀硫酸,能使溶液变为棕黄色 2溶液中滴加稀硫酸,能使溶液变为棕黄色 |
| D.将Fe(OH)3胶体装在U形管中做电泳实验时,负(阴)极一端颜色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com