
| A. | ①②⑥⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
分析 ①具有一定质子数,一定中子数的原子为核素;
②质子数相同中子数不同的同种元素的不同原子互称同位素;
③同种元素组成的不同单质为同素异形体;
④根据同周期稀有气体的原子序数推断;
⑤氢元素有3种核素,无法确定氢元素质量数;
⑥根据质子数相同,而中子数不同的原子互为同位素来分析解答,“同位”指核素的质子数相同使同种元素;
⑦互为同位素的原子物理性质不相同,化学性质相同.
解答 解:①具有一定质子数,一定中子数的原子为核素,1H、2H、3H质子数都为1,中子数分别为0、1、2,它们为氢元素的三种不同的核素,故①正确;
②质子数相同中子数不同的同种元素的不同原子互称同位素,1H、2H、3H质子数都为1,中子数分别为0、1、2,1H、2H、3H为同位素,故②正确;
③同种元素组成的不同单质为同素异形体,1H、2H、3H是原子,不是同素异形体,故③错误;
④第七周期0族元素的原子数序为86+32=118,则114号元素应位于第七周期ⅣA族,故④错误;
⑤1H、2H、3H质量数分别为1、2、3,无法确定氢元素质量数,故⑤错误;
⑥同位素是质子数相同,而中子数不同的原子,同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置,故⑥正确;
⑦化学性质与元素的核外电子排布有关,互为同位素的原子质子数相同,化学性质相同,同位素质量数不同,物理性质不同,故⑦错误;
故选C.
点评 本题考查了核素、同位素、同素异形体、元素在周期表中的位置、同素异形体等概念的分析理解,掌握概念实质以及原子符号的意义是关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 每个四氢大麻酚分子中含有3个手性碳原子 | |
| B. | 四氢大麻酚能与FeCl3溶液发生显色反应 | |
| C. | 1mol四氢大麻酚最多可与1molBr2发生加成反应 | |
| D. | 1mol四氢大麻酚与NaOH溶液反应,最多消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、Na+、SO42- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Mg2+、Na+、Cl-、NO3- | D. | Ba2+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
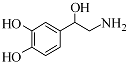
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有2个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有规则几何外形的固体均为晶体 | |
| B. | 晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射 | |
| C. | 晶体研碎后即变为非晶体 | |
| D. | 将玻璃加工成规则的固体即变成晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com