
| A. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
分析 A、乙烯和环丁烷的最简式均为CH2;
B、C3H6可能是丙烯,也可能为环丙烷;
C、-OH中含9个电子;
D、标况下,三氯甲烷为液态.
解答 解:A、乙烯和环丁烷的最简式均为CH2,故28g混合物中含有的CH2的物质的量为n=$\frac{28g}{14g/mol}$=2mol,故含有碳原子为2NA个,故A正确;
B、C3H6可能是丙烯,也可能为环丙烷,故结构中不一定含碳碳双键,故B错误;
C、-OH中含9个电子,故1mol-OH中含9mol电子即9NA个,故C错误;
D、标况下,三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
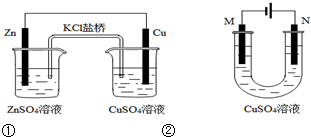
| A. | 装置①中盐桥内的K+移向CuSO4溶液 | |
| B. | 装置①将电能转变为化学能 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则N极为粗铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | 4HNO3═4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
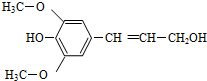 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式是C11H12O4 | |
| B. | 芥子醇分子中所有碳原子可能在同一平面 | |
| C. | 1mol芥子醇能与足量溴水反应消耗3molBr2 | |
| D. | 1mol芥子醇与足量的氢气反应消耗氢气4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
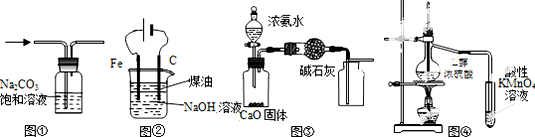
| A. | 图①除去CO2中的HCl | |
| B. | 图②装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 图④证明CH3CH2OH发生消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com