
分析 无机盐A,加入足量6%的H2O2溶液,充分反应生成水、气态氧化物B,气态单质C,盐D和含氧强酸E;B、C、D、E均通(加)入Ba(OH)2溶液中,B、D、E与Ba(OH)2生成了白色沉淀,再向白色沉淀中加入足量稀硝酸,只有B生成的沉淀溶解且放出气体B,则B为CO2,含氧强酸E为H2SO4,A、D的焰色呈紫色,则含有钾元素,所以D为K2SO4,C在标况下的密度为1.25g/L,则M=ρVm=1.25g/L×22.4L/mol=28g/mol,所以该单质气体为N2,所以A中含有K、C、S、N元素,则A为KSCN;
(1)由分析可知C为N2;
(2)KSCN与H2O2反应生成CO2、N2、K2SO4、H2O、H2SO4,KSCN中K为+1价,S为-2价,N为-3价,C为+4价,根据得失电子守恒和原子守恒配平方程式;
(3)CO2与Ba(OH)2反应生成BaCO3和水;
(4)短周期的金属单质R在CO2、N2中都能燃烧,则R为Mg.
解答 解:无机盐A,加入足量6%的H2O2溶液,充分反应生成水、气态氧化物B,气态单质C,盐D和含氧强酸E;B、C、D、E均通(加)入Ba(OH)2溶液中,B、D、E与Ba(OH)2生成了白色沉淀,再向白色沉淀中加入足量稀硝酸,只有B生成的沉淀溶解且放出气体B,则B为CO2,含氧强酸E为H2SO4,A、D的焰色呈紫色,则含有钾元素,所以D为K2SO4,C在标况下的密度为1.25g/L,则M=ρVm=1.25g/L×22.4L/mol=28g/mol,所以该单质气体为N2,所以A中含有K、C、S、N元素,则A为KSCN;
(1)由分析可知C为N2,为直线形分子,结构式为N≡N,故答案为:N≡N;
(2)KSCN与H2O2反应生成CO2、N2、K2SO4、H2O、H2SO4,KSCN中K为+1价,S为-2价,N为-3价,C为+4价,生成产物中CO2中C为+4价,N2为0价,K2SO4中S为+6价,H2SO4中S为+6价,则配平方程式为:2KSCN+11H2O2=2CO2↑+N2↑+K2SO4+10H2O+H2SO4;
故答案为:2KSCN+11H2O2=2CO2↑+N2↑+K2SO4+10H2O+H2SO4;
(3)CO2与Ba(OH)2反应生成BaCO3和水,其反应的离子方程式为:CO2+Ba2++2OH-=BaCO3↓+H2O,故答案为:CO2+Ba2++2OH-=BaCO3↓+H2O;
(4)短周期的金属单质R在CO2、N2中都能燃烧,则R为Mg,由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,N2+3Mg$\frac{\underline{\;点燃\;}}{\;}$Mg3N2,可知1molCO2消耗2molMg,1molN2消耗3molMg,则等体积的B、C完全反应消耗金属单质R的质量比为2:3,故答案为:2:3.
点评 本题考查了物质组成的探究实验,题目难度较大,涉及的知识点较多,注意掌握无机推断的方法与技巧,明确有关化学方程式的书写、计算方法,试题充分考查了学生的分析、理解能力及化学计算能力.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
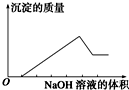 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
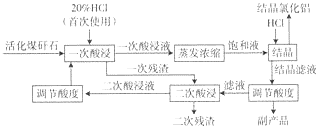
| HCl气体体积/(m3.L-1) | 结晶效率/% | HCl利用效率/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中的SO2溶于水,最终形成酸雨 | |
| B. | 汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物 | |
| C. | 工业废水任意排放是造成酸雨的主要原因 | |
| D. | 为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | 在一定条件下,CO2原子晶体转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和CO2分子晶体具有相同的物理性质 | |
| D. | 在CO2的原子晶体中,每个碳原子周围结合四个氧原子,每个氧原子周围结合两个碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com