
分析 A、B、C、D为短周期元素,核电荷数依次增大,A是原子结构最简单的元素,故A为氢,属于第一周期,A、B、C三种元素的原子核外电子层数之和为5,故B、C只能处于第二周期,B元素原子最外层上的电子数是其电子层数的2倍,最外层电子数为4,则B为碳元素,A和C之间可形成A2C和A2C2两种化合物,故C为氧元素;D在同周期主族元素中原子半径最大,处于IA族,原子序数大于氧,故D为Na.
解答 解:A、B、C、D为短周期元素,核电荷数依次增大,A是原子结构最简单的元素,故A为氢,属于第一周期,A、B、C三种元素的原子核外电子层数之和为5,故B、C只能处于第二周期,B元素原子最外层上的电子数是其电子层数的2倍,最外层电子数为4,则B为碳元素,A和C之间可形成A2C和A2C2两种化合物,故C为氧元素;D在同周期主族元素中原子半径最大,处于IA族,原子序数大于氧,故D为Na.
(1)C为氧元素,在元素周期表中的位置是第二周期第VIA族,CO2的结构式为O=C=O,
故答案为:第二周期第VIA族;O=C=O;
(2)C、D两种元素所形成的简单离子分别为O2-、Na+,二者电子层结构相同,核电荷数越大离子半径越小,故离子半径由大到小的顺序是:O2-、Na+,
故答案为:O2-、Na+;
(3)设转化的水的物质的量为amol,则
C(s)+H2O(g)?CO(g)+H2(g)
开始(mol):1 0 0
转化(mol):a a a
平衡(mol):1-a a a
2min后容器的压强增加了20%,则1mol×(1+20%)=1+a,解a=0.2,故2min内H2O的反应速率为$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
A.增加固体单质的量,不会影响化学反应速率,故A错误;
B.恒温恒容时在该容器中通入Ar,不改变反应中各种物质的浓度,故化学反应速率不变,故B错误;
C.随反应过程中,混合气体的质量增大,容器体积不变,混合气体密度增大,密度不再变化可以判断该反应达到了平衡,故C正确;
D.2min时,H2O的转化率为$\frac{0.2mol}{1mol}$×100=20%,故D错误;
E.1mol水反应得到1molCO、1mol氢气,生成物的平均相对分子质量为15,故混合气体中平均相对分子质量减小,平均相对分子质量不变说明到达平衡,故E正确.
故答案为:0.05mol/(L•min);CE;
(4)CO燃烧生成二氧化碳,二氧化碳与碱反应生成碳酸根,负极发生氧化反应,故燃料电池的负极反应为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
(5)Na的单质与乙醇反应的化学方程式:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑,
故答案为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑;
(6)将0.2mol Na2O2投入到含有0.1mol FeCl2的水溶液中充分反应,过氧化钠反应得到0.4molNaOH、0.1mol氧气,0.1mol FeCl2反应消耗0.2molNaOH,得到0.1mol Fe(OH)2,剩余0.2molNaOH,0.1mol Fe(OH)2转化为0.1mol Fe(OH)3消耗氧气为$\frac{0.1mol}{4}$=0.025mol,则剩余0.075mol氧气,反应的总的化学方程式为:8Na2O2+4FeCl2+H2O═4Fe(OH)3↓+8NaOH+8NaCl+3O2↑,
故答案为:8Na2O2+4FeCl2+H2O═4Fe(OH)3↓+8NaOH+8NaCl+3O2↑.
点评 本题以元素推断为载体,考查结构性质位置关系应用、化学平衡有关计算、原电池、化学计算、方程式书写等,(6)为易错点,是对基础知识的综合考查,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:选择题
| A. | 在卤代烃中,卤素原子与碳原子间形成共价键 | |
| B. | 在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 | |
| C. | 聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 | |
| D. | 卤代烃的沸点比相应烷烃的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH=CHCH2CH3不存在顺反异构体 | |
| B. | 分子式为C5H10O2的羧酸有8种 | |
| C. | 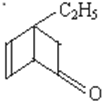 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 | |
| D. | 棱晶烷  为正三棱柱形,它的二氯代物有5种 为正三棱柱形,它的二氯代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3(CH2)4CH3 | B. | CH3CH2CHO | C. | CH3CH=CHCH3 | D. | (CH3)3C-C≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 显蓝色、无现象、显黄色 | B. | 显蓝色、红色沉淀、无现象 | ||
| C. | 无现象、变黑色、显黄色 | D. | 显蓝色、变红色、黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的离子键被破坏 | B. | NaCl的共价键被破坏 | ||
| C. | HCl和NaCl的化学键均遭破坏 | D. | HCl和NaCl的化学键均未遭破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl只代表一种物质 | B. | CH2Cl2只代表一种物质 | ||
| C. | CHCl3只代表一种物质 | D. | CCl4是非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com