
分析 Ⅰ、(1)氧化还原反应中,失电子总数=得电子总数=转移电子总数,根据电子守恒配平方程式,化合价降低元素所在的产物是还原产物;
(2)同周期元素的原子,从左到右,原子半径逐渐减小;
(3)因为具有氧化性而具有漂白性的物质:次氯酸、次氯酸盐、过氧化钠等;
Ⅱ、钠溶于盐酸后,溶液增加的质量=钠的质量-氢气的质量,镁溶于盐酸后,溶液增加的质量=镁的质量-氢气的质量;
Ⅲ、由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,并注意物质的状态来解答;纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大.
解答 解:Ⅰ、(1)反应中C元素的化合价从+3升高到了+4价,共失电子2mol,Cl元素的化合价从+5价降到了+4价,共得到电子1mol,所以含氯元素物质前边的系数都是2,二氧化碳的系数是2,根据元素守恒,硫酸、硫酸钠的前边吸水都是1,水的前边系数是2,
故答案为:1;2;1;1;2;2;2;
(2)上述反应物中属于第三周期的元素的原子是Na、S、Cl,半径大小顺序是Na>S>Cl,故答案为:Na>S>Cl;
(3)因为具有氧化性而具有漂白性的物质:次氯酸、次氯酸盐、过氧化钠等,故答案为:HClO(合理即可);
Ⅱ、1mol钠和1mol镁反应时盐酸均过量,钠和镁均完全反应,故生成的氢气的物质的量取决于钠和镁.1mol钠和盐酸反应生成0.5mol氢气,1mol镁和足量盐酸反应生成1mol氢气,氯化钠溶液中增加的质量=23g/mol×1mol-0.5mol×2g/mol=22g,
氯化镁溶液中增加的质量=24g/mol×1mol-1mol×2g/mol=22g,所以溶液a和b的质量大小关系为ma=mb,
故答案为:=;
Ⅲ、由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1;纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大,去污效果好,水解离子反应为反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1;CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-.
点评 本题目综合考查学生氧化还原反应的配平、电子转移、物质的漂白原理、热化学方程式的书写以及水解原理等知识,注意知识的归纳和整理是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | NaOH和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
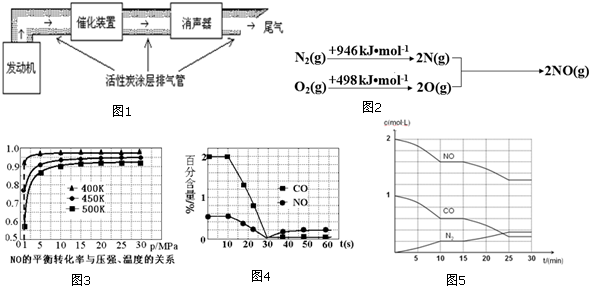
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
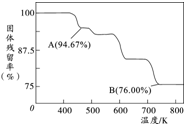 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2S液中:c(OH-)-c(HS-)-c(H+)=2c(H2S) | |
| B. | 0.2mol/L的NH3•H2O溶液和0.1mol/LHCl溶液等体积混合(pH>7):c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | 0.1mol/L pH=7.8的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 0.1mol/L Na2SO3溶液与0.1mol/L NaHSO3溶液等体积混合:2c(Na+)-3c(SO32-)=3c(HSO3-)+3c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
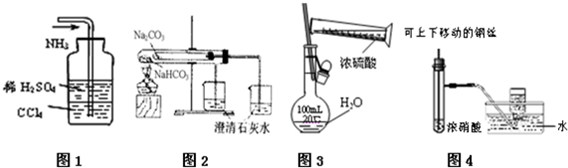
| A. | 图1吸收多余的NH3 | |
| B. | 图2为比较NaHCO3、Na2CO3相对热稳定性 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图4为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p3 | B. | 1s22s22p3 | C. | 1s22s2sp4 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com