
【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
【答案】 碱性 > 酸性 < 中性 > < m>n
【解析】本题主要考查弱酸电离及其盐类水解。
(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,形成醋酸钠溶液,醋酸钠水解使溶液呈碱性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且碱性溶液中,[H+]<[OH-],所以[Na+]>[CH3COO-]。
(2)醋酸难电离,常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,由于醋酸浓度较大而剩余,醋酸电离使溶液呈酸性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且酸性溶液中,[H+]>[OH-],所以[Na+]<[CH3COO-]。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],由于溶液中醋酸根离子和钠离子浓度相等,所以[H+]=[OH-],则混合后溶液呈中性,与(1)比较可知醋酸溶液的体积>氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,由于醋酸难电离,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-),与(1)比较可知m与n的大小关系式为m>n。
【题型】填空题
【结束】
23
【题目】某温度(T℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
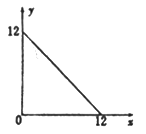
(1)此温度下,水的离子积KW=______________,则该温度T________25℃(填“>” “<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH 如下表所示:
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=________, 实验②中由水电离产生的[OH-]=______mol·L-1。
(3)在此温度下,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol L-l NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显__________性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:____________________ 。
③按甲方式混合后,所得溶液的pH 为_____________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a________(填“>” “<”或“=”)0.01;用含a的代数式表示HCN 的电离常数Ka=___________。
【答案】 1×10-12 > 4 10-7 中 Ba2++OH-+H++SO42-=BaSO4↓+H2O 11 > (100a-l)×10-7 mol L-1
【解析】本题主要考查有关pH的计算。
(1)此温度下,水的离子积KW=[H+][OH-]=10-x·10-y=10-12·100=1×10-12>1×10-14,升温促进水的电离,则该温度T>25℃。
(2)由实验①可知,在此温度下,Ba(OH)2溶液的pH=8,[OH-]=![]() =
=![]() mol/L=1×10-4mo1/L,在22.00mLBa(OH)2溶液中逐滴加入pH=a的盐酸22.00mL,pH=6,混合溶液呈中性,则盐酸中[H+]=1×10-4mol/L,a=4,实验②中由水电离产生的[OH-]=[H+]=1×10-7mol·L-1。
mol/L=1×10-4mo1/L,在22.00mLBa(OH)2溶液中逐滴加入pH=a的盐酸22.00mL,pH=6,混合溶液呈中性,则盐酸中[H+]=1×10-4mol/L,a=4,实验②中由水电离产生的[OH-]=[H+]=1×10-7mol·L-1。
(3)在此温度下,0.1mol·L-1的NaHSO4溶液中[H+]=0.1mol·L-1,0.1mol·L-1的Ba(OH)2溶液中[OH-]=0.2mol·L-1。
①按丁方式混合后,由于n(OH-)=n(H+),所以所得溶液显中性。
②按乙方式混合后,反应的离子方程式:Ba2++OH-+H++SO42-=BaSO4↓+H2O。
③按甲方式混合后,OH-剩余一半,所得溶液的[OH-]=(0.2×10-0.1×5)/(10+5)mo1/L=0.1mol/L,[H+]= ![]() =
=![]() mol/L =1×10-11mo1/L,pH为11。
mol/L =1×10-11mo1/L,pH为11。
(4)NaCN+HCl=HCN+NaCl,若NaCN与HCl恰好完全反应生成HCN和NaCl,则HCN电离产生H+而使溶液呈酸性,只有反应剩余能够水解产生OH-的NaCN时,才能使得溶液pH=7,所以a>0.01;Ka=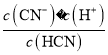 =
=![]() mol L-1=(100a-l)×10-7mol L-1。
mol L-1=(100a-l)×10-7mol L-1。


科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br-废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。
已知:①2NaOH+Cl2==NaCl+NaClO+H2O
②Br2极易溶于四氯化碳和正十二烷
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
在水中溶解性 | 微溶 | 难溶 | 难溶 |

下列说法不正确的是
A. 甲装置中Br-发生的反应为:2Br-+Cl2===Br2+2Cl-
B. 甲装置中NaOH溶液每吸收1个Cl2,转移1个e-
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种中枢神经兴奋剂,其合成路线如下图所示。
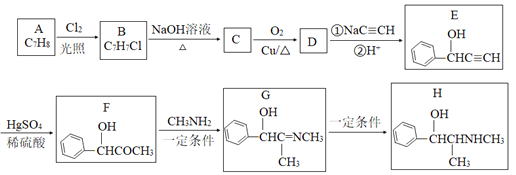
请回答下列题:
(1)A的化学名称为_________,C的结构简式为________。
(2)E中官能团的名称为________。B→C、G→H的反应类型分别为________、________。
(3)D分子中最多有_____个原子共平面。
(4)F→G历经两步反应,第一步反应的化学方程式为______________。
(5)同时满足下列条件的F的同分异构体有_____种(不考虑立体异构)。
①能发生银镜反应;②能与氯化铁溶液反应;③分子中只有1个甲基。
其中核磁共振氢谱有6组峰的结构简式为__________。
(6)参照上述合成路线和信息,以乙烯为原料制备强吸水性树脂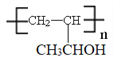 的合成路线流程图(可选择题干中相关试剂,无机试剂任选)_____________________________。
的合成路线流程图(可选择题干中相关试剂,无机试剂任选)_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
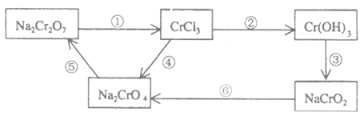
(1)配平并回答问题,用单线桥标出2个反应的电子转移的方向和数目。
反应①为:__Na2Cr2O7+__HCl→__NaCl+__CrCl3+__Cl2↑+____,氧化剂_______,氧化产物__________。
反应⑥为:__ClO3-+__CrO2-+____→__Cl-+__CrO42-+__H2O,还原剂________,还原产物__________。
(2)在上述有编号的步骤中,除了①⑥外,需用氧化剂的步骤是(填编号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,其结构简式如图所示。下列说法不正确的是( )

A. CPAE能发生取代反应、加成反应
B. CPAE能使酸性高锰酸钾溶液褪色
C. CPAE可与氢氧化钠溶液发生反应
D. CPAE在酸性条件下水解得到相对分子质量较小的有机物的同分异构体共有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标准状况下,2.24L 四氯化碳含有的分子数目为 0.1NA
B. 25℃时,0.1 mol·L-1Na2S溶液中含有Na+的数目为0.2NA
C. 64g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是食用碘盐的添加剂,工业上制取KIO3的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )
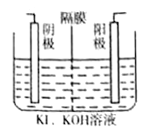
A. 可用铁作阳极、石墨作阴极
B. 装置中的隔膜为阳离子隔膜
C. 当外电路中通过2 mole-时,阴极上会有22.4LH2生成
D. 阳极电极反应式为:I--6e-+6OH-=IO3-+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com