
| 滴定次数 | 待测溶液体积/ml[ | 标准NaOH溶液体积读数(ml) | |
| 滴定前/ml | 滴定后/ml | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.30 | 22.30 |
分析 (1)①配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,据此判断使用的仪器;
②根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断误差;
③滴定时眼睛应注意观察溶液颜色变化,以确定终点;
④如溶液颜色发生变化,且30s内不褪色;
(2)先根据数据的有效性,然后求出标准溶液的体积的平均值,根据中和反应实质计算出溶液中H+的物质的量,根据方程式可知(CH2)6N4H+的物质的量,进而确定样品中氮的质量分数.
解答 解:(1)①配制一定物质的量浓度的溶液250mL,称量样品通常使用托盘天平和药匙,溶解时使用烧杯和玻璃棒,转移溶液使用250mL容量瓶和玻璃棒,定容使用胶头滴管,所以用到的主要玻璃仪器有:250 mL容量瓶、胶头滴管、烧杯、玻璃棒;
故答案为:250 mL容量瓶、胶头滴管、烧杯、玻璃棒;
②酸式滴定管用蒸馏水洗涤后,直接加入样品溶液进行量取,溶液被稀释,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏小,最终求出的NH4+的物质的量偏小,样品中氮质量分数偏小;
锥形瓶用蒸馏水洗涤后,水未倒尽,待测液的物质的量不变,NaOH标准溶液的体积无影响;
滴定时对NaOH标准溶液体积,读取初读数时仰视,读取终读数时姿势正确,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏小,最终求出的NH4+的物质的量偏小,样品中氮质量分数偏小;
故答案为:偏低;无影响;偏低
③定时边滴边摇动锥形瓶,眼睛应注意观察颜色变化,确定滴定终点;
故答案为:B;
④待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为浅红色,所以滴定终点时,溶液从无色变为浅红色,30s内不褪色;
故答案为:无;浅红;
(2)依据图表数据分析可知,三次实验中消耗氢氧化钠溶液体积分别为:20.01ml、19.99ml、20.00ml,三次均有效,氢氧化钠溶液的平均体积为20.00mL;
根据题意中性甲醛溶液一定是过量的,而且1.500g样品经溶解后,取了其中$\frac{1}{10}$进行滴定,即0.15g,溶液中含有H+(含(CH2)6N4H+)共0.02L××0.1010mol/L=0.00202mol,
根据4NH4++6HCHO═3H++6H2O+(CH2)6N4H+,每生成4molH+(含(CH2)6N4H+),会消耗NH4+4mol,所以共消耗NH4+0.00202mol,其中含氮元素0.00202mol×14g/mol=0.02828g,所以氮的质量分数为$\frac{0.02828}{0.15}$×100%=18.85%;
故答案为:20.00mL;18.85%.
点评 本题考查物质的含量的测定,侧重于中和滴定的考查,注重于学生实验能力和分析能力和计算能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的2p电子数是2s电子数的一半,由Y、Z元素合物是一种常用的漂白剂、供氧剂,Z和R位于同周期且R的基态原子中有3个电子能量最高,M2+与过量氨水作用先得到蓝色沉淀后转化为深蓝色溶液Q,请回答下列问题:
X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的2p电子数是2s电子数的一半,由Y、Z元素合物是一种常用的漂白剂、供氧剂,Z和R位于同周期且R的基态原子中有3个电子能量最高,M2+与过量氨水作用先得到蓝色沉淀后转化为深蓝色溶液Q,请回答下列问题:查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
有100 mL 3.5 mol·L-1的NaOH溶液和100 mL 1 mol/L的AlCl3溶液,按如下两种方法进行实验:
①将NaOH溶液分多次加入到AlCl3溶液中(边加边搅拌);
②将AlCl3溶液分多次加入到NaOH溶液中(边加边搅拌)。
比较两次实验的结果,其中正确的是( )
A.现象相同,沉淀量相等 B.现象不同,沉淀量不等
C.现象相同,沉淀量不等 D.现象不同,沉淀量相等
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
1 mol Na2O2晶体和1 mol Na2O的晶体中阴离子的个数比较,前者和后者的关系是( )
A.前者大 B.前者小 C.相等 D.不能肯定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:填空题
工业上常用FeCl3溶液制印刷电路板并再生,主要过程如下:
腐蚀Cu:2FeCl3+Cu=CuCl2+2FeC12;
然后回收Cu:Fe+CuCl2=Cu+FeCl2;
再生FeC13:2FeC12+C12=2FeC13。
将某电路板上的Cu腐蚀完全,恰好消耗0.5L2mol/LFeCl3。全过程忽略体积的变化。
回答下列问题:
(1)画出Cl原子结构示意图:________________;
(2)将Cu腐蚀一半时,溶液中的金属阳离子有:_______________;此时c(Cl-)为:____________mol/L;
(3)腐蚀的Cu的总物质的量为:______________mol;
(4)再生FeC13时,溶液由___________色最终变为___________色;消耗的Cl2在标准状况下的体积至少为:________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2-3次 | |
| B. | 可使用酚酞或甲基橙作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准溶液的刻度时,滴定前平视,滴定后仰视,测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
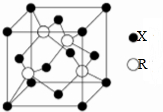
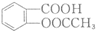 和
和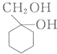 的流程路线.
的流程路线.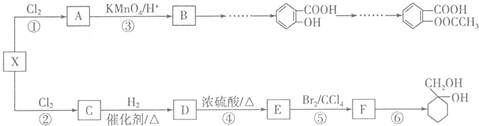
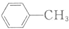 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$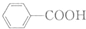
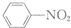 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$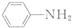 (苯胺,易被氧化)
(苯胺,易被氧化)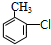 .
.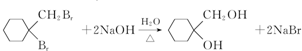 .
.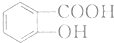 有多种同分异构体,写出符合下列条件的同分异构体的结构简式
有多种同分异构体,写出符合下列条件的同分异构体的结构简式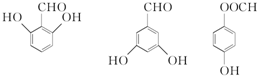 (任写一种).
(任写一种).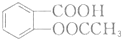 的结构与性质,说法正确的是AD.
的结构与性质,说法正确的是AD.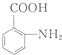 最合理的方案,请在答题纸的方框中表示.
最合理的方案,请在答题纸的方框中表示.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的N2和CO | B. | 同密度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同温度、同体积的N2O和CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com