
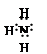
 (2分)
(2分)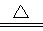 NaAlO2 + NH3↑(2分)
NaAlO2 + NH3↑(2分)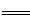 2Al(OH)3+CO32-(2分)
2Al(OH)3+CO32-(2分) 2Fe +N2 +3H2O(2分) , 取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成(2分,其他合理答案也给分)
2Fe +N2 +3H2O(2分) , 取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成(2分,其他合理答案也给分) Si3N4 +6CO(2分)
Si3N4 +6CO(2分)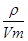 =0.76g·L-1×22.4L·mol-1≈17g·mol-1,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;
=0.76g·L-1×22.4L·mol-1≈17g·mol-1,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;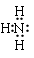 ;
; NaAlO2+NH3↑;
NaAlO2+NH3↑; 2Al(OH)3↓+CO32-;
2Al(OH)3↓+CO32-; 2Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
2Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成; Si3N4+6CO。
Si3N4+6CO。

科目:高中化学 来源:不详 题型:单选题
| A.少量明矾溶液加入到过量NaOH溶液中 |
| B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液 |
| C.少量Na2O2固体加入到过量NaHSO4溶液中 |
| D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
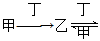 丙。下列有关物质的推断不正确的是 ( )。
丙。下列有关物质的推断不正确的是 ( )。| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为SO2,则丁可能是氨水 |
| C.若甲为Fe,则丁可能是盐酸 |
| D.若甲为NaOH溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.④⑤ | B.①③ | C.②③ | D.①② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硅是生产光纤制品的基本原料 |
| B.水玻璃可用于生产黏合剂和防火剂 |
| C.盐析可提纯蛋白质并保持其生理活性 |
| D.石油分馏可获得乙烯、丙烯和丁二烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯水和SO2可使品红褪色 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.氯水和活性炭使红墨水褪色 |
| D.氢氧化钠溶液和石灰水暴露在空气中变质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。下列有关物质的推断不正确的是 ( )
。下列有关物质的推断不正确的是 ( )| A.若甲为Fe,则丁可能是盐酸 |
| B.若甲为SO2,则丁可能是氨水 |
| C.若甲为焦炭,则丁可能是O2 |
| D.若甲为NaOH 溶液,则丁可能是CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com