
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是
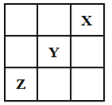
A. Y的氢化物稳定性大于Z的氢化物稳定性
B. Z一定是活泼的金属元素
C. Y的最高价氧化物的水化物是一种强酸
D. 1molX的单质可以跟足量水反应,转移的电子为2mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学活动小组利用以下装置,制备LiH固体。
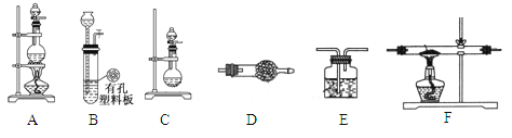
(1)元素锂在周期表中的位置 __________________。
(2)在LiH固体中比较离子半径大小关系r(Li+) _________r(H-)。(填“>”或“<”)
(3)活动小组准备利用上述部分装置制备LiH固体。可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰。已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是___________________(不必写出具体的操作方法);加入药品后,其中装置D的作用是____________________________。
②通入一段时间氢气后加热石英管,在加热F处的石英管之前,必须进行的实验操作是_______________________________。
③加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。完成LiH与水反应的化学方程式___________________________________。
④准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液,B和C反应发出苍白色火焰。请回答:
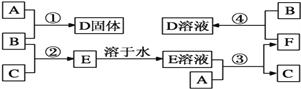
(1)A是_________,B是_________,C是_________![]() 填写化学式
填写化学式![]() ;
;
(2)反应①的化学方程式 ______________________________________;
(3)反应③的离子方程式 _____________________________________;
(4)反应④的离子方程式 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4molL﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
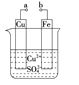
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据所学知识,回答下列问题:
(1)元素周期表1~20号元素中,金属性最强的元素是______(填元素符号,下同);属于稀有气体的是_________;非金属性最强的元素在周期表中的位置是__________________。
(2)己知NO2和N2O4之间发生可逆反应:2NO2(g)(红棕色)![]() N2O4(g)(无色)。将装有NO2和N2O4混合气体的烧瓶浸入热水中,观察到的现象是_______,产生该现象的原因是________。
N2O4(g)(无色)。将装有NO2和N2O4混合气体的烧瓶浸入热水中,观察到的现象是_______,产生该现象的原因是________。
(3)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),5min时反应达到平衡状态,测得c(N2)=0.02mol/L。
2NH3(g),5min时反应达到平衡状态,测得c(N2)=0.02mol/L。
①0~5min内,v(NH3)=_______________。
②下列叙述可证明上述反应达到平衡状态的是________(填序号)。
a.V(H2)=3v(N2)
b.容器内压强保持不变
c.每消耗ImolN2,同时生成2molNH3
d.N2、H2和NH3的物质的量浓度不再变化
II.五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。回答下列问题:
(1)五种元素中,原子半径最大的是______(填元素名称),非金属性最强元素的是_________。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是_____(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为______,其中存在的化学键类型为______________。
(4)E离子的结构示意图是____________;元素D最高价氧化物的水化物的化学式为_____。
(5)单质E与水反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶2 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是( )
A.![]() L
L
B.![]()
C.![]()
D.![]() L
L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com