
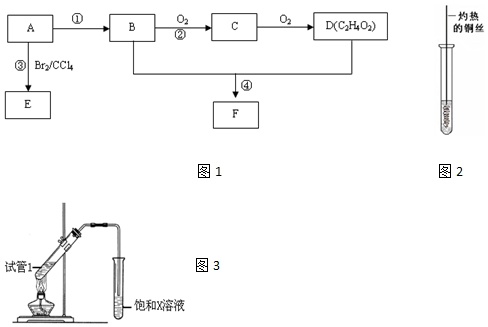
 ,D中官能团为羧基(-COOH).
,D中官能团为羧基(-COOH). CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O. 分析 气态烃A在标况下的密度为1.25g/L,其摩尔质量=1.25g/L×22.4L/mol=28g/mol,A是一种重要的化工原料,它的产量通常用来衡量一个国家石油化工水平,故A是乙烯,B和D都是生活中常见的有机物,乙烯和水发生加成反应生成B,则B是乙醇,乙醇和氧气反应生成C,则C是乙醛,C和氧气反应生成D,D是乙酸,乙醇和乙酸反应生成F为乙酸乙酯,A与溴发生加成反应生成1,2-二溴乙烷,以此来解答.
解答 解:(1)A是一种气态烃,在标准状况下的密度是1.25g/L,摩尔质量=1.25g/L×22.4L/mol=28g/mol,其产量是衡量一个国家石油化工发展水平,则A为CH2=CH2,A的结构简式为CH2=CH2,B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结合D的分子式可知,B为CH3CH2OH,B中官能团的电子式为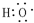 ,乙醇和氧气反应生成C,则C是乙醛,C和氧气反应生成D,D是乙酸,D中官能团的名称为羧基(-COOH),
,乙醇和氧气反应生成C,则C是乙醛,C和氧气反应生成D,D是乙酸,D中官能团的名称为羧基(-COOH),
故答案为:CH2=CH2;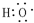 ;羧基(-COOH);
;羧基(-COOH);
(2)A为CH2=CH2,反应①为乙烯与水的加成反应,反应的化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,反应③是乙烯与溴发生加成反应生成1,2-二溴乙烷,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:加成反应;CH2=CH2+Br2→CH2BrCH2Br;
(3)B是乙醇,乙醇和氧气反应生成C,则C是乙醛,所以反应②的化学方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)C是乙醛,乙醛和新制Cu(OH)2的反应发生氧化反应,乙醛分子中的醛基被氧化为羧基,氢氧化铜被还原为氧化亚铜红色沉淀:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;
(5)B、D在浓硫酸的作用下实现反应④,B为CH3CH2OH,D是乙酸,在乙酸乙酯的制备实验中,用饱和的碳酸钠溶液吸收乙酸乙酯中的乙酸与乙醇,能溶解乙醇,吸收乙酸,2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑,有利于乙酸乙酯的分层,所以X为Na2CO3,其作用是abd,反应④的化学方程式为:CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:Na2CO3;abd;CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
点评 本题考查有机物推断,关键是掌握烯与醇、醛、羧酸的性质与转化,熟练掌握有机反应类型是解答关键,注意掌握常见有机物官能团及其性质,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝与盐酸反应:Al2O3+6H+═2Al3++3H2O | |
| B. | 氢氧化铝与NaOH溶液反应:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无机化合物可根据其组成和性质进行分类
无机化合物可根据其组成和性质进行分类| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素为Mn元素 | B. | 该元素最高化合价为+7 | ||
| C. | 该元素属于d区元素 | D. | 该元素原子最外层共有7个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com