


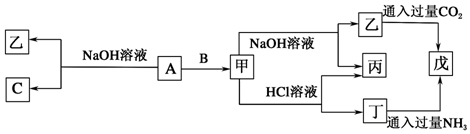
 .检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.
.检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族. 分析 A和甲在高温下发生置换反应,且有金属单质参加和生成,应为铝热反应,则甲为Al,乙为Fe,F是红褐色沉淀,应为Fe(OH)3,则A为Fe2O3,G是淡黄色固体粉末,应为Na2O2,则B为Al2O3,戊为O2,H为NaAlO2,乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1,则丙为Cu,丁应为Cl2,C为FeCl3,D为CuCl2,E为FeCl2,K是丁的气态氢化物,应为HCl,则I为AlCl3,J为Al(OH)3,结合对应单质、化合物的性质以及元素周期律的递变规律可解答该题.
解答 解:(1)由以上分析可知G为Na2O2,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(2)甲为Al,原子核外有13个电子,电子排布式为1s22s22p63s23p1,同周期元素从左到右第一电离能逐渐增大,由于Mg最外层为2个电子,达到稳定结构,难以失去电子,则第一电离能最大,则有Na<Al<Mg,故答案为:1s22s22p63s23p1;Na<Al<Mg;
(3)反应②为AlO2-和Al3+的互促水解反应,反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
(4)乙为Fe,价层电子排布为3d64s2,高价阳离子为Fe3+,最高能级电子为3d5,排布图为 ,丙为Cu,基态原子外围电子排布式为3d104s1,位于周期表第四周期ⅠB族,
,丙为Cu,基态原子外围电子排布式为3d104s1,位于周期表第四周期ⅠB族,
故答案为: ;3d104s1;第四周期ⅠB族.
;3d104s1;第四周期ⅠB族.
点评 本题考查无机物的推断,为高考常见题型,题目比较综合,难度较大,本题在解答时注意根据题给信息正确推断物质的种类为解答该题的关键,答题时注意把握题给信息,正确处理物质反应之间的关系.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,产生H2速率减小,H2体积不变 | |
| B. | 加入NH4HSO4固体,产生H2速率不变,H2体积不变 | |
| C. | 加入CH3COONa固体,产生H2速率减小,H2体积减小 | |
| D. | 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
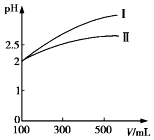 乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:
乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | Ka=l.8×l0-5 | Ka=4.9×10-10 | Kal=4.3×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
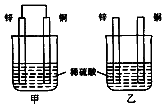
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 两烧杯中溶液的pH均增大 | |
| C. | 甲中电子通过导线由锌片流向铜片,再回到锌片 | |
| D. | 乙中产生气泡的速度比甲快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
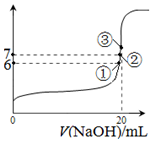 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Ca2+ | C. | I- | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com