

 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是 (写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为: 。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是 (写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为: 。 )= 。
)= 。 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
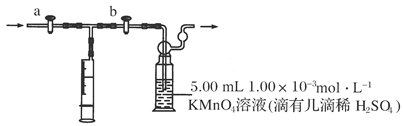
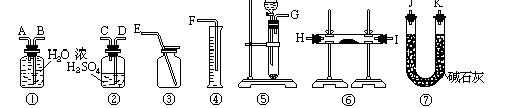
 装置可以是_____________,其中盛放的药品是____________。
装置可以是_____________,其中盛放的药品是____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
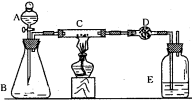
 (1)装置C的作用是 _______,装置E的作用是 。
(1)装置C的作用是 _______,装置E的作用是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
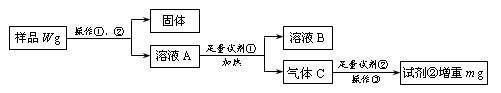
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,用稀硫酸进行酸化 |
| B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 |
| C.除去苯中的甲苯,依次加高锰酸钾溶液、NaOH溶液,然后用分液漏斗分液 |
| D.检验CH3—CH==CH—CHO分子中醛基,可用溴水或银氨溶液。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com