
【题目】【选修3:物质结构与性质】(15分)A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式______________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为____________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_________________。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为___________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为_____________。

(6)G与氮元素形成的某种化合物的晶胞结构如右图,则该化合物的化学式为__________,若晶体密度为a g·cm-3,列式计算G原子与氮原子最近的距离为__________pm(不必计算出数值,阿伏加德罗常数的值用NA表示)。
【答案】(1)1s22s22p63s2 (1分)
(2)非极性 (1分);2(1分)
(3) (2分)
(2分)
(4)HF分子之间存在氢键,形成缔合分子(2分)
(5)Al(CH3)3 (1分) sp2杂化(2分)
Al(CH3)3 +3H2O=Al(OH)3↓+3CH4↑(2分)
(6)Cu3N (1分) ×1010(2分)
×1010(2分)
【解析】
试题分析:在前四周期中原子序数依次增大的七种元素A、B、C、D、E、F、G中,A的原子核外电子只有一种运动状态,故A为H;B、C的价电子层中未成对电子数都是2,则B、C核外电子排布为1s22s22p2或1s22s22p4,为C、O;B、C、D同周期且原子序数依次增大,故D为F;E核外的s、p能级的电子总数相等,故E为Mg,F与E同周期且第一电离能比E小,F为Na,G的+1价离子(G+)的各层电子全充满,元素的基态原子最外能层只有一个电子,其它能层均已充满电子,则核外电子数为2+8+18+1=29,故G为Cu。
(1)E为Mg元素,基态原子的电子排布为1s22s22p63s2;
(2)B(C)与C(O)可形成化合物BC(CO)和BC2(CO2),CO2结构式为O=C=O,电荷中心重合,为非极性分子,CO的结构式为C≡O,含有2molπ键;
(3)Cu(H2O)42+,水与铜离子形成4个配位键,结构为 ;
;
(4)测定A、D形成的化合物HF的相对分子质量时,实验测定值一般高于理论值的原因是HF分子之间存在氢键,形成缔合分子;
(5)由元素H、C、Al组成的原子个数比9:3:1的一种物质,分子中含三个相同的原子团,其结构简式为Al(CH3)3,根据价层电子对互斥理论计算电子对数为3+(3-3×1)/2=3,杂化类型为sp2,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为Al(CH3)3 +3H2O=Al(OH)3↓+3CH4↑;
(6)晶胞中Cu原子数目=12×1/4=3、N原子数目=8×1/8=1,故化学式为:Cu3N;晶胞的质量=(64×3+14)÷NA g,紧邻的白球与黑球之间的距离为bcm,则晶胞棱长=2bcm,则晶胞体积=(2bcm)3,故晶体的密度=[(64×3+14)÷NA]÷(2bcm)3=agcm-3,b= 。
。


科目:高中化学 来源: 题型:
【题目】A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系:

试填写下列空白:
(1)甲元素的单质在空气中燃烧产物除了得到A外,还可得到_____________,物质F的电子式为____________。
(2)反应“E+D→G+B”是制硝酸工业中的重要反应之一,其方程式为______________“E+CuO”的化学方程式为_________________
(3)C和D还能在一定条件下反应生成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 工业上可通过CO和H2化合制得CH3OH: CO(g)+2H2(g) ![]() CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
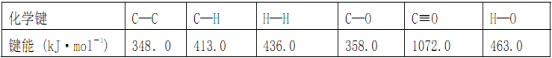
则ΔH =_____________,在相应的反应条件下,将 1 mol CO(g)与足量H2混合充分反应后,则放出或吸收的热量Q ________ ΔH 的数值(填“>”、“=”或“<”)。
Ⅱ.电化学降解NO3-的原理如右图所示。

①电源 A 极为________(填“正极”或“负极”),阴极反应式为_______________。
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为________g。
Ⅲ.已知NO2和N2O4的相互转化反应:2NO2(g)![]() N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:

①图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
②前 10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min)。
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_____________(用文字表达);其平衡常数 K(d)________K(b)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们经常食用的牛、羊、猪等肉类和白菜、土豆等蔬菜,经消化吸收后,其中的成分可被转化为人体的组成成分。对以上事实解释合理的是
A. 组成生物体细胞的化学元素在无机自然界都能找到
B. 不同生物的细胞内,组成它们的化学元素含量大体相同
C. 组成生物体细胞的生物大分子都是以碳链作为骨架
D. 不同生物的细胞内,组成它们的化学元素种类大体相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol白磷转化为红磷时放出18.39kJ热量,已知:P4(白磷,s)+5O2(g)=2P2O5(s) ΔH=-a kJ/mol(a>0);4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-bkJ/mol(b>0),则a和b的关系是( )
A. a > b B. a = b C. a < b D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A.向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O
B.向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O==HClO+HCO![]()
C.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO![]() 完全沉淀:
完全沉淀:
NH4++Al3++SO42-+Ba2++4OH-==NH3·H2O+Al(OH)3↓+BaSO4↓
D.酸性溶液中KIO3与KI反应:I-+IO3-+6H+==I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不利于“开源节流”的是
A. 开发太阳能、水能、风能、地热能等新能源
B. 大力开采煤、石油和天然气,以满足人们日益增长的能源需求
C. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
D. 减少资源消耗,注重资源的重复使用、资源的循环再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
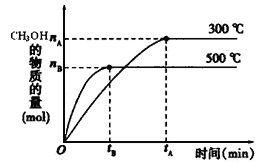
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)___________________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种制氧剂,它和二氧化碳反应方程式为:2Na2O2+2CO2→2Na2CO3+O2下列说法正确的是
A. Na2O2是氧化剂,CO2是还原剂
B. Na2CO3是还原产物,O2是氧化产物
C. 每转移4摩尔电子,有1摩尔氧气生成,
D. 1摩尔CO2参加反应就会产生11.2LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com