
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
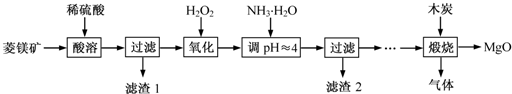
| ||
| ||
| ||
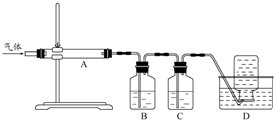
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 仪器 | 加入试剂 | 预期实验现象 |
| A | 绿矾试样 | 残留红棕色固体 残留红棕色固体 |
| B | 无水硫酸铜 无水硫酸铜 |
白色粉末变蓝 白色粉末变蓝 |
| D | 品红或酸性高锰酸钾溶液或溴水 品红或酸性高锰酸钾溶液或溴水 |
溶液褪色 溶液褪色 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2是氧化产物 | B、Na2FeO4既是氧化产物又是还原产物 | C、2mol FeSO4发生反应时,共有10mol电子转移 | D、Na2O2在反应中只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源:2013届河南省灵宝市第三高级中学高三上学期第三次质量检测化学试卷(带解析) 题型:单选题
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是: 
2FeSO4 Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、(II)x溶液、(III)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
| A.(I)中会生成BaSO3、BaSO4两种沉淀 |
| B.可将(I)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C.(III)的作用是检验生成的SO2气体 |
| D.(II)所盛x应为品红溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com