
某一反应体系中共有As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质。已知 As2S3是反应物之一,试写出并配平这个方程式和指出氧化产物。
3As2S3+ 28HNO3+4H2O→ 6H3AsO4+9H2SO4+28NO↑, H3AsO4、 H2SO4
由题给的提示可确定反应物为 As2S3和 HNO3,NO、H3AsO4、H2O为生成物,H2O可以是反应物,也可以是生成物,待以后进一步确定。由此可得如下未配平的化学方程式: As2S3+ HNO3→ H3AsO4+ H2SO4+NO↑,接着开始配平这一方程式。
+3 -2 +5 +5 +6 +2
As2S3+ HNO3→ H3AsO4+ H2SO4+NO↑
根据质量守恒定律检查发现,方程式左边缺少8个H原子和4个0原子,所以水为反应物。完整的方程式为: 3As2S3+ 28HNO3+4H2O→ 6H3AsO4+9H2SO4+28NO↑由化合价升降情况分析可知氧化产物为 H3AsO4、 H2SO4。


科目:高中化学 来源: 题型:
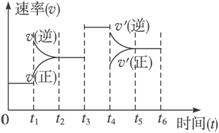
( )
6
A.该曲线中处于平衡状态的时间段共有3个
B.C的百分含量最高的时间段是0—t1
C.t1时刻可能是体系升温引起的变化
D.t4时刻可能是容器扩大体积引起的变化
查看答案和解析>>
科目:高中化学 来源:河北省模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com