
下列实验设计和结论相符的是 ( )
A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液一定有Fe2+
C.向饱和Na2CO3中通入足量CO2 ,溶液变浑浊,析出了NaHCO3
D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
(1)某温度(t℃)时,测得0.01 mol·L-1 NaOH溶液的pH=13,请回答下列问题:
 ①此温度下水的Kw= 。
①此温度下水的Kw= 。
 ②此温度下,将pH=12的NaOH溶液VaL与pH=2的H2SO4溶液VbL混合(忽略体积变化),若所得混合液的pH=3,则Va︰Vb= 。
②此温度下,将pH=12的NaOH溶液VaL与pH=2的H2SO4溶液VbL混合(忽略体积变化),若所得混合液的pH=3,则Va︰Vb= 。
(2)25℃时,pH=a的20mL的H2SO4溶液与c(H+)=10-b的200mL的NaOH溶液混合后,溶液呈中性,则a和b满足的关系___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物因果关系的叙述中,完全正确的一组是( )
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳双键 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成二氧化碳 |
| C | 乙醇是电解质 | 乙醇可与钠反应放出氢气 |
| D | 乙酸乙酯和乙烯在一定条件下都能与水反应 | 二者属于同一反应类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于0.1mol/LNa2CO3溶液的叙述错误的是 ( )
A.0.5L该溶液中钠离子的物质的量浓度为0. 05mol/L
B.1L该溶液中含有Na2CO3的质量为10.6g
C.从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.1mol/L
D.取该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,一定能大量共存的一组离子是 ( )
A.溶液的pH=13:ClO-、HCO 、Na+、Mg2+
、Na+、Mg2+
B.溶液中含有大量NO :NH
:NH 、I-、SO
、I-、SO 、H+
、H+
C.溶液中c(HCO )=0.1 mol/L:Na+、K+、CO
)=0.1 mol/L:Na+、K+、CO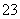 、Br-
、Br-
D.溶液中由水电离出的c(H+)=1×10-13mol/L:Na+、H+、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
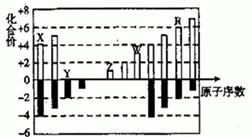
短周期元素X 、Y 、Z 、W 、R 的化合价与原子序数的关系如图所示。
下列说法正确的是 ( )
A.最高价氧化物水化物的酸性:X > R
B.气态氢化物的稳定性:Y < R
C.Z 和Y 形成的化合物是离子化合物
D.常温下单质W 能溶于R 的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 。用氧化还原滴定法测定TiO2质量分数的步骤如下:①在一定条件下,将TiO2溶解并还原为Ti3+ ,②以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为____________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
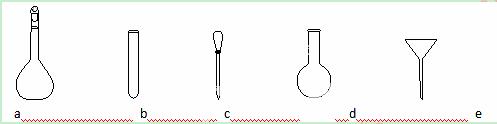
(4)滴定终点的现象是___________________________________________________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_______________。
若在配制标准溶液过程中,俯视定容,使测定结果___________________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组对某溶液进行了多次的检测,其中三次检测结果如下表所示。请回答问题:
| 溶液中检测出的溶质 | |
| 第一次 | KCl、K2SO4 、Na2CO3、NaCl |
| 第二次 | KCl、K2CO3、Na2SO4、NaCl |
| 第三次 | KCl、BaCl2 、Na2CO3、NaCl |
(1)三次检测结果中,第 次的结果肯定不正确。
(2)该小组成员进行了如下实验,进一步确定溶液中存在SO42-、CO32-和Cl-,请将空格填充完整:
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验 ① 的存在 | ② |
| 第二步 | 继续滴加过量的 ③ 溶液 | 检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加 ⑤ 溶液 | 检验 ⑥ 的存在 | Ag++Cl-=AgCl↓ |
(3)在上述实验的第一步中,不能将硝酸改为稀盐酸。原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验中的下列操作正确的是 ( )
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
C.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com