
���� ���Ʋ�����̼���ƺͶ������跴Ӧ���ɹ����ƺͶ�����̼��ʯ��ʯ��ʯӢ��Ӧ���ɹ���ƺͶ�����̼��
�ڸ�����Ϣ����ϵͳ��ʹ���˹��ά�����ά����Ҫ�ɷ��Ƕ������裻
��� �⣺���Ʋ����Ĺ����з����˷�Ӧ��̼���ƺͶ������跴ӦNa2CO3+SiO2$\frac{\underline{\;����\;}}{\;}$Na2SiO3+CO2����ʯ��ʯ��ʯӢ��Ӧ��CaCO3+SiO2$\frac{\underline{\;����\;}}{\;}$CaSiO3+CO2����
�ʴ�Ϊ��Na2CO3+SiO2$\frac{\underline{\;����\;}}{\;}$Na2SiO3+CO2����CaCO3+SiO2$\frac{\underline{\;����\;}}{\;}$CaSiO3+CO2����
�ڸ�����Ϣ����ϵͳ��ʹ���˹��ά�����ά����Ҫ�ɷ��Ƕ������裬��ѡc��
���� ���⿼���������йصĻ�ѧ֪ʶ����Ŀ�ѶȲ���ע�������֪ʶ�Ļ��ۣ�ע�ⲣ��������ԭ������Ҫ�ɷ֣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ý�̿��ԭSiO2��ȡ�ֹ� | |
| B�� | ������۵��Ӳ�ȴ���˿����������뵼����� | |
| C�� | ʯӢֻ�������������ά | |
| D�� | ���������ɳ���ʢ�Ÿ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
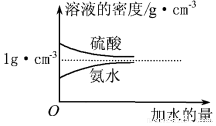
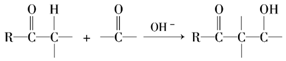 ��
��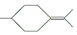 ���������մ��Ľṹ��ʽΪ
���������մ��Ľṹ��ʽΪ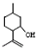 ��
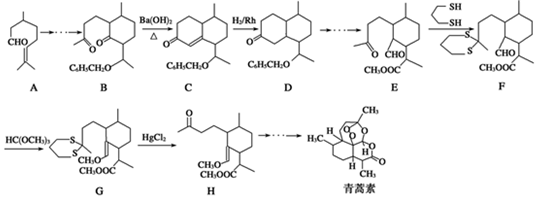
�� ���ĺϳ�·������ͼ�����Լ���ѡ����
���ĺϳ�·������ͼ�����Լ���ѡ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
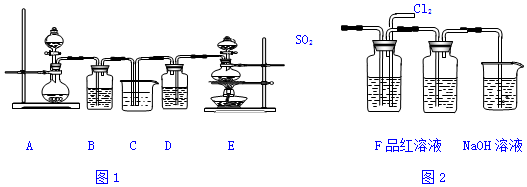
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ȼ��仯�������������������й㷺����;���ش��������⣺
�ȼ��仯�������������������й㷺����;���ش��������⣺| ������� | �¶�/�� | �������/L | Cl02��g����ƽ��ת���� |
| a | T1 | V1=l L | 75% |
| b | T1 | v2 | |
| c | T3 | v3 | 75% |
| d | |||
| e |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com