
【题目】下列各组离子,能在溶液中大量共存的是
A. K+、H+、SO42、OHB. Na+、Ca2+、NO3、CO32
C. Na+、H+、Cl、CO32D. Na+、Cu2+、Cl、SO42
科目:高中化学 来源: 题型:
【题目】锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO42-(绿色)、MnO4-(紫色)形式存在。MnO2不溶于稀硫酸。
(1)将8 mL 0.1 mol·L-1的酸性高锰酸钾溶液和2 mL l.0mol/L的草酸(H2C2O4)溶液在试管中混合,然后将试管置于25℃水浴中,KMnO4溶液浓度随时间变化关系如下图所示。
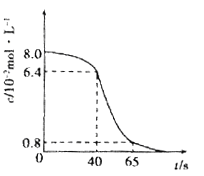
① 写出发生反应的离子方程式:____________
② 计算前40秒用草酸表示的平均反应速率v(草酸)=________________.
③ 40s-65s的反应速率比前40s快,解释原因___________
(2)已知反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-。
MnO2+2MnO4-+4OH-。
① 向MnO4-溶液中加入足量稀硫酸,可观察到的现象是__________.
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时K2MnO4的转化率为4/9,则该反应的平衡常数的值为__________
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,则该反应的△H___0(填“大于” “小于”或“等于”)。
(3)碳酸锰是一种重要的工业原料。工业生产中常用复分解法生产MnCO3:
MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4. 溶液的pH不能过低也不能过高,原因是_______。设MnSO4溶液为0.19mol/L,则溶液的pH 最高不能超过_________。
[己知MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13]
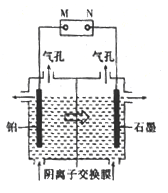
(4)制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中“![]() ”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于原电池的电极名称,叙述错误的是( )
A. 发生氧化反应的一极为负极B. 正极为电子流入的一极
C. 比较不活泼的金属为负极D. 电流流出的一极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和氨气是重要的工业原料,二者在常温下混合即可发生反应。某兴趣小组同学拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。回答下列问题:

(1)气体的制备与净化
① 氯气的发生装置可以选择上图中的_____,反应的化学方程式为_________。
② 干燥氨气选用上图中的______。氯气的净化装置的连接顺序为b![]() __________(按气流顺序,用小写字母表示)。
__________(按气流顺序,用小写字母表示)。
(2)氨气与氯气的反应
①上图中的装置连接顺序为A![]() _____
_____![]()
![]()
![]() B (用大写字母表示)。
B (用大写字母表示)。
氨气的入口是____(填“e”或“f”),原因是_______。另一生成物是空气的主要成分之一,试写出该反应的化学方程式:__________,写出一种此反应的工业用途:____________。
② 设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): __________。
若从装置D的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有__________的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不属于同分异构体的是( )
A.2,2﹣二甲基丙醇和2﹣甲基丁醇
B.邻氯甲苯和对氯甲苯
C.2﹣甲基丁烷和戊烷
D.甲基丙烯酸和甲酸丙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g) + 3Y(g) ![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2molCu2(OH)2CO3后,恰好使溶液恢复到电解前的浓度。则电解过程中转移电子的物质的量为( )
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com