
| 实验 | 实验目的 |
| A.测定等物质的量浓度的 CH3COONa和Na2S溶液pH | 比较 CH3COOH和H2S的酸性强弱 |
B.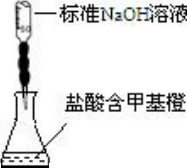 | 测定盐酸的浓度 |
C.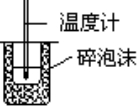 | 测定中和热 |
| D.先用酚酞,后用甲基橙作指示剂,用标准盐酸滴定0.1 mol/L的Na2CO3溶液 | 证明 CO32-水解分两步 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Na2S对应的酸是HS-而不是H2S;
B.碱滴定酸时,用甲基橙作指示剂颜色变化不明显;
C.中和热的测定时需要环形玻璃搅拌棒搅拌溶液;
D.碳酸钠和稀盐酸反应先生成碳酸氢钠后碳酸氢钠和稀盐酸反应生成氯化钠,酚酞的变色范围为8-10,甲基橙的变色范围是3.1-4.4.
解答 解:A.Na2S对应的酸是HS-而不是H2S,所以不能根据等物质的量浓度的 CH3COONa和Na2S溶液pH比较CH3COOH和H2S的酸性强弱,应该根据等物质的量浓度的 CH3COONa和NaHS溶液pH比较CH3COOH和H2S的酸性强弱,故A错误;
B.碱滴定酸时,用甲基橙作指示剂颜色变化不明显,应该选取酚酞作指示剂,如果是酸滴定碱用甲基橙作指示剂,故B错误;
C.中和热的测定时需要环形玻璃搅拌棒搅拌溶液,否则溶液温度不均导致测定值不准确,故C错误;
D.酚酞的变色范围为8-10,甲基橙的变色范围是3.1-4.4,碳酸钠和稀盐酸反应先生成碳酸氢钠后碳酸氢钠和稀盐酸反应生成氯化钠,从而证明 CO32-水解分两步,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及酸性强弱比较、盐类水解、指示剂的选取、中和热测定等知识点,综合性较强,明确实验原理、实验基本操作是解本题关键,易错选项是A,注意多元酸的钠盐中酸根离子对应酸成分,题目难度中等.


科目:高中化学 来源: 题型:解答题
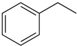 (g)→
(g)→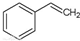 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L丙烷中含有的共用电子对数为NA | |
| B. | 25℃时,pH=1的盐酸和醋酸溶液所含H+数均为0.1 NA | |
| C. | 利用双氧水制氧气,每生成1molO2转移电子数为4 NA | |
| D. | 100mL 12mo1•L-1的浓盐酸与足量MnO2加热反应,生成C12分子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 氮化铝是铝合金中的一种 | |
| C. | 上述反应中每生成2molAlN,N失去6mol电子 | |
| D. | 氮化铝中氮元素的化合价为-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 无色透明的酸性溶液中:Al3+、NH4+、Cl?、HCO3? | |
| C. | pH=1的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3 COO-、SO42-、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=+480.4kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-480.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 纯铁的熔点比生铁的低,抗腐蚀能力比生铁强 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com