


| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
分析 (1)由操作流程可知实验原理是Al(NO3)3和氨水反应生成Al(OH)3,经过滤、洗涤、灼烧后生成Al2O3,根据Al2O3的质量可确定的Al(NO3)3待测液中c(Al3+);
(2)原电池工作时,控制的温度应为满足Na、S为熔融状态,Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此解答;
(3)左侧溶液变蓝色,生成I2,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,右侧放出氢气,右侧I-、OH-通过阴离子交换膜向左侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,一段时间后,蓝色变浅,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,由此分析解答.
解答 解:(1)①由操作流程可知实验原理是Al(NO3)3和氨水反应生成Al(OH)3,试剂a为氨水,反应的方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
②由操作流程可知实验原理是Al(NO3)3和氨水反应生成Al(OH)3,经过滤得到Al(OH)3固体,所以操作b为过滤;
故答案为:过滤;
③n(Al2O3)=$\frac{mg}{102g/mol}$=$\frac{m}{102}$mol,
则n(Al(NO3)3)=2n(Al2O3)=$\frac{m}{51}$mol,
c(Al(NO3)3)=$\frac{\frac{m}{51}}{v×10{\;}^{-3}}$=$\frac{1000m}{51v}$mol/L,
故答案为:$\frac{1000m}{51v}$;
(2)①原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有C符合,
故答案为:C;
②放电时,Na被氧化,则A应为原电池负极,B为正极发生还原反应,故答案为:负;还原;
③充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故答案为:Sx2--2e-═xS;
(3)根据以上分析,左侧溶液变蓝色,生成I2,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,右侧I-、OH-通过阴离子交换膜向左侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,一段时间后,蓝色变浅,故答案为:2H2O+2e-= H2↑+2OH-;右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应.
点评 本题考查较为综合,涉及物质的分离、提纯以及含量的测定和原电池电解池知识,侧重于学生的分析能力、实验能力、计算能力的考查,为高频考点,注意相关基础知识的积累,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
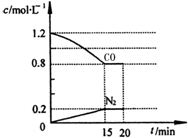 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.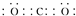 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积就是22.4 L/mol | |
| B. | 1 mol H2的质量只有在标况下才约为2 g | |
| C. | 标况下,18克H2O的体积为22.4 L | |
| D. | H2和O2的混合气体1 mol在标况下的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 | |
| C. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| D. | c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 在含有浓度均为0.001 mol•L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
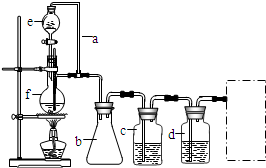 某学习小组拟以下列合成路线合成1-丁醇:
某学习小组拟以下列合成路线合成1-丁醇: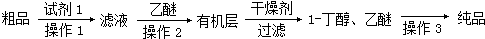
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | pH=2的酸溶液1mL,加水稀释至100mL后,溶液pH=4 | |
| C. | 过量SO2通入Ba(NO3)2溶液中,正确的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ | |
| D. | 用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com