
|
|


科目:高中化学 来源:必修一导学指导化学苏教版 苏教版 题型:021
|
由两种金属构成的合金15 g,加入到足量的稀硫酸中,直到反应不再进行,收集并测得产生气体的体积为11.2 L(标准状况),则该合金的组成可能是 | |
A. |
Cu、Zn |
B. |
Mg、Al |
C. |
Al、Fe |
D. |
Mg、Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.Cu、Zn B.Mg、Al C.Al、Fe D.Mg、Ag
查看答案和解析>>
科目:高中化学 来源:2009-2010学年贵州省遵义四中高二(上)期中化学试卷(理科)(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期中考试化学试卷(解析版) 题型:选择题
Mg、Cu合金8.4g完全溶于浓硝酸中,若反应中硝酸被还原,只产生4480mLNO2和2240mLN2O4,反应后的溶液中加足量的NaOH溶液,生成的沉淀再经灼烧后所得固体质量为:
A.15.2 g, B.11.6g C.13.5g, D.16.6 g
【解析】根据反应过程不难判断,生成的沉淀是氢氧化镁和氢氧化铜,灼烧得到的是氧化镁和氧化铜,因为金属每失去2mol电子,就要结合1mol氧原子。硝酸的还原产物是NO2和N2O4,转移的电子是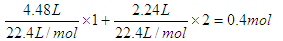 ,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com